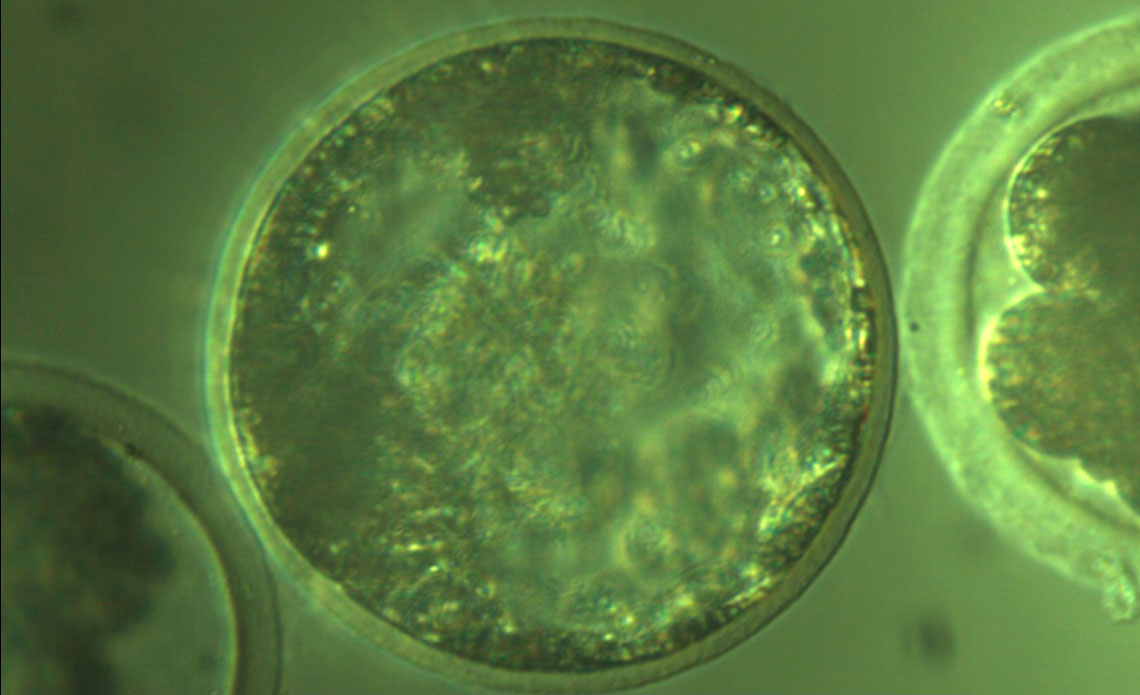
Em pé em uma sala escura, a veterinária e embriologista Ligiane Leme observava atentamente a tela de um computador, a única fonte de luz no local. Passava um pouco das 11 da manhã do dia 10 de abril e o monitor exibia a imagem de um óvulo imaturo, seguro por uma micropipeta próximo a uma diminuta agulha. Nos instantes seguintes, a embriologista Georgina Hastenreiter moveu a agulha com o auxílio de um joystick e fez uma perfuração mínima na célula, por meio da qual, com movimentos rápidos e precisos, extraiu todo o seu material genético. O óvulo sem núcleo foi depois preenchido com o DNA de uma célula adulta de pele de porco.
Naquele dia e no seguinte, Leme, Hastenreiter e a biomédica Tainah Moraes repetiriam o procedimento em outros 600 óvulos coletados em um abatedouro no interior de São Paulo. Acondicionadas em um meio de cultura, as células reprodutivas das porcas foram levadas para o Centro de Estudos do Genoma Humano e de Células-Tronco da Universidade de São Paulo (CEGH-CEL-USP), financiado pela FAPESP, onde seriam usadas em mais uma etapa do desenvolvimento de um projeto ambicioso: a tentativa de produzir no Brasil clones de animais geneticamente modificados para fornecer órgãos a seres humanos e, assim, quem sabe, ajudar a reduzir a fila de espera por transplantes. Segundo dados do Ministério da Saúde, 71 mil pessoas aguardavam um órgão ou tecido em abril.
“O país tem o maior sistema público de transplantes de órgãos do mundo”, lembra Ernesto Goulart, farmacêutico especialista em bioengenharia de tecidos e líder do projeto na USP. “Acreditamos ter a obrigação de desenvolver uma estratégia que permita a esse sistema se manter funcionando bem e atendendo mais pessoas”, afirma o pesquisador.
O projeto é coordenado pela geneticista Mayana Zatz, do CEGH-CEL, e pelo cirurgião Silvano Raia, da Faculdade de Medicina (FM-USP). Após aporte inicial da empresa farmacêutica EMS, ele vem sendo financiado pela FAPESP e pelo governo federal e envolve quase 50 pesquisadores da universidade e da Empresa Brasileira de Pesquisa Agropecuária (Embrapa), da Universidade Federal de São Paulo (Unifesp) e do Instituto de Pesquisas Tecnológicas (IPT).
“O transplante de órgãos foi o maior progresso da história da cirurgia. De 2000 a 2022, foram realizados 2 milhões no mundo. Como são indicados para evitar o óbito, pode se considerar 2 milhões de vidas salvas”, conta Raia. “Devido ao sucesso, há uma demanda reprimida. Isso justifica a busca de órgãos adicionais”, afirma o cirurgião, pioneiro em realizar transplante de fígado com doador vivo no mundo.
Ao final daqueles dois dias de abril, as pesquisadoras haviam obtido 280 embriões clonados, que foram transferidos para o útero de duas fêmeas híbridas das raças landrace e large white. Se tudo sair como o planejado, em meados de maio será possível saber se as porcas estão prenhes e de quantos filhotes. A expectativa é, após os quase quatro meses de gestação, testemunhar o nascimento de ao menos um leitão.
Quando a clonagem der certo, queremos estar prontos para testar as células editadas, afirma Goulart, da USP
A torcida é grande, apesar da baixa taxa de sucesso da técnica. Só uma pequena parte dos embriões obtidos por clonagem e transferidos para as fêmeas receptoras se implanta no útero e, destes, uma fração ainda menor (de 1% a 5%) completa a gestação e nasce.
No último ano, a equipe de Leme já produziu mais de 10 mil embriões clonados de porcos e realizou 20 transferências para as receptoras, com a inserção de cerca de 200 por vez. Todas as vezes as fêmeas ficaram prenhes e, em algumas, os fetos se desenvolveram por até 50 dias, quase metade de uma gestação suína. Até o momento, nenhuma prenhez resultou no nascimento de um filhote, algo que os pesquisadores esperam que mude em breve, com os aprimoramentos feitos a cada nova tentativa. “No Brasil, há tempos é feita a clonagem de bovinos, mas essa tecnologia ainda não foi estabelecida para suínos”, conta Goulart. “O uso da técnica em porcos é mais limitada, devido a características dos gametas da espécie”, explica Leme.
A dificuldade de dominar a técnica é geral. Cerca de 15 grupos em ao menos oito países tentam clonar porcos geneticamente modificados para obter órgãos, mas só três conseguiram. Um é o da empresa eGenesis, nos Estados Unidos, fornecedora do rim transplantado em março para um homem com insuficiência renal.
Tudo pode afetar a obtenção do clone: a temperatura de manipulação das células, a incidência de luz (por isso a sala é escura), a sincronização entre o estágio de divisão da célula doadora do DNA e o do óvulo, além da fase do ciclo reprodutivo em que os embriões são transferidos para a receptora e do número de embriões efetivamente implantados no útero. Suínos têm de 20 a 25 filhotes por ninhada e, se a quantidade de embriões for muito menor, a gestação não segue adiante. Em abril, a equipe da USP passou a contar com a consultoria do veterinário e embriologista brasileiro Luis Queiroz, que auxiliou o desenvolvimento dos animais da eGenesis, para aprimorar a clonagem.
Obter os primeiros porquinhos clonados será a confirmação de que o grupo da USP finalmente dominou a técnica, passo essencial e complementar a outro necessário para obter órgãos mais compatíveis com os dos seres humanos: a edição genética das células. Apesar das diferenças genéticas e de outras incompatibilidades, os porcos têm sido os animais doadores de escolha nos últimos anos porque têm órgãos com tamanho e funcionamento semelhantes aos dos humanos, além de serem domesticados, se reproduzirem bem em cativeiro e originarem ninhadas grandes em poucos meses.
Há cinco anos, antes das tentativas de clonagem, Goulart e os biólogos Luiz Caires e Luciano Abreu Brito haviam começado os primeiros testes para alterar a configuração genética das células suínas e, assim, reduzir um dos principais riscos do transplante: a rejeição. Resultado do ataque do sistema de defesa do receptor ao novo órgão, a rejeição também pode ocorrer quando os doadores são seres humanos. Mas costuma ser mais frequente com órgãos de outros animais, o chamado xenotransplante.
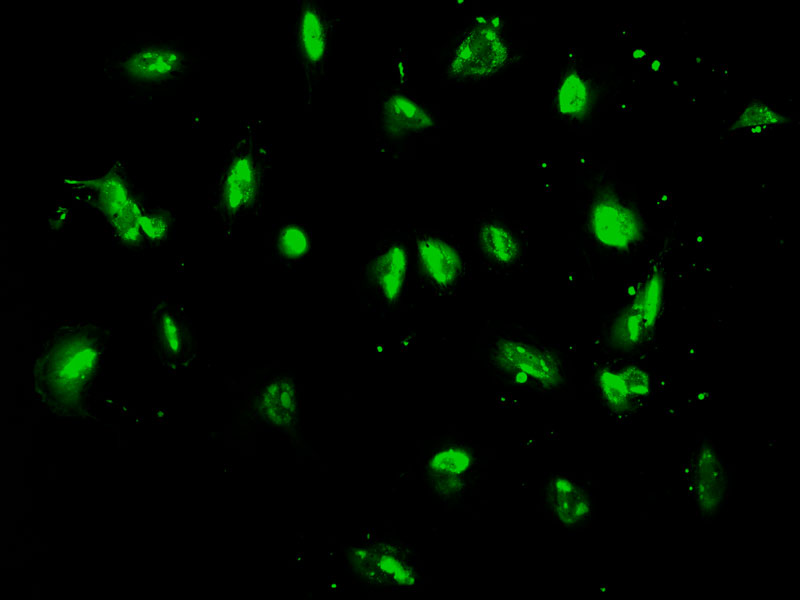
Instalados no Laboratório de Edição Gênica do CEGH-CEL, em uma sala vizinha à de clonagem, Goulart, Brito e colaboradores empregam duas técnicas para manipular o material genético das células a serem usadas na geração dos clones. Uma é a ferramenta de edição gênica Crispr-Cas 9 (ver Pesquisa FAPESP nº 288).
Com ela, a equipe da USP já conseguiu desativar os três genes normalmente desligados nos experimentos de xenotransplante: o GGTA1, o CMHA e o B4GALNT2. Eles codificam enzimas que atuam na produção de açúcares da superfície das células suínas que são reconhecidos pelo sistema imunológico humano e disparam a rejeição hiperaguda: a destruição do órgão nas primeiras horas ou dias após o transplante, causada por anticorpos presentes no sangue do receptor.
Mais recentemente, o grupo começou a usar uma segunda técnica – a transposon piggybac, que emprega um trecho de DNA capaz de cortar a dupla fita do material genético celular e inserir novos segmentos – para acrescentar sete genes humanos às células suínas. O objetivo é gerar células – e, consequentemente, embriões e órgãos – com características mais próximas às do ser humano para driblar o sistema de defesa e evitar a produção de novos anticorpos, causa da rejeição aguda, que pode ocorrer meses após o transplante. “Todo processo de edição genética, em especial o acréscimo de genes, é delicado. Representa uma agressão à célula”, esclarece Brito.
Até abril, os pesquisadores já haviam conseguido inserir os genes em fibroblastos, as células da pele que se mostraram mais apropriadas para a clonagem, mas ainda não sabiam se eles haviam sido incorporados no trecho desejado do genoma nem se permitiam a produção de níveis adequados das proteínas que codificam. Por isso, planejavam sequenciar o DNA dos fibroblastos para ver o ponto de inserção dos genes.
“Quando a clonagem der certo, queremos estar prontos para testar as células editadas”, afirma Goulart, que espera obter, além de rins, córneas, coração e pele para xenotransplante. Os porcos clonados e as proles resultantes do cruzamento entre eles serão mantidas em duas instalações especiais, projetadas para a criação de animais doadores de órgãos para uso humano. A primeira, com capacidade para até 10 animais, foi inaugurada em 23 de abril no campus da USP em São Paulo. Outra, maior, está em construção no IPT. Após o nascimento, os animais ficarão sob os cuidados da XenoBR, startup resultante do projeto que fornecerá os órgãos para os testes clínicos.
O avanço das técnicas de edição gênica da última década, com a promessa de redução do risco de rejeição, reavivou o interesse médico por órgãos de origem animal – uma busca antiga, documentada desde ao menos o século XVII (ver linha do tempo abaixo). De 2022 para cá, ao menos três doentes graves receberam como alternativa derradeira (tratamento compassivo) o transplante de um órgão suíno.