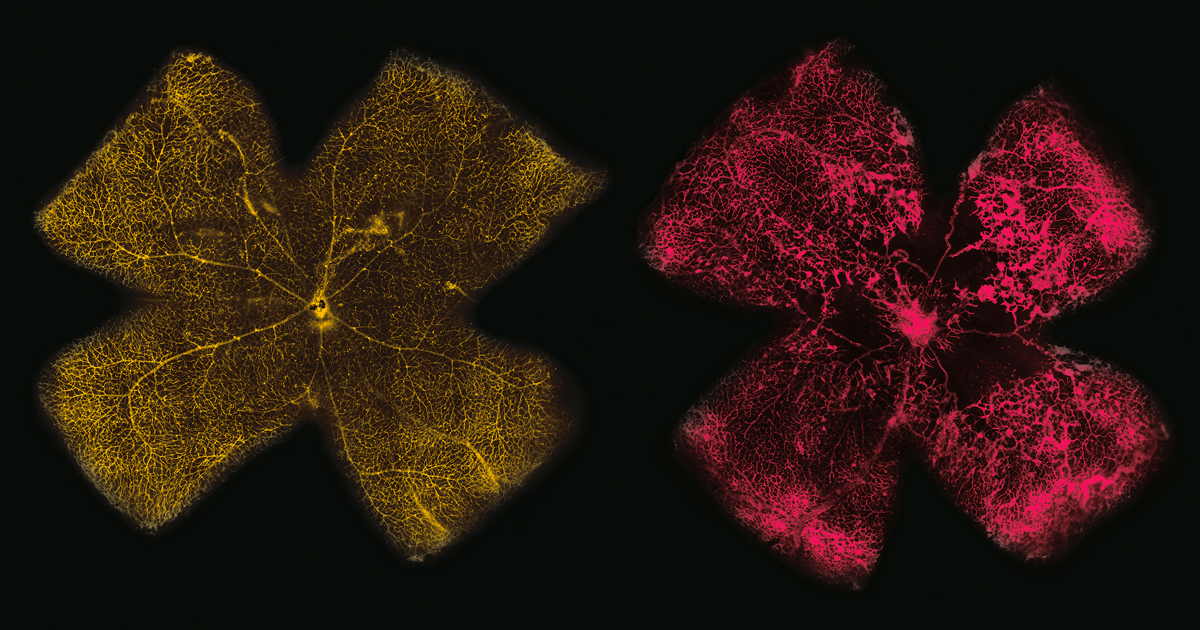
Pesquisadores da Universidade de São Paulo (USP) estão ajudando a conhecer alterações no funcionamento das células da retina que levam uma proporção elevada dos bebês prematuros, que pode superar os 30% em algumas regiões e países, a ter problemas de visão. Localizada na parte posterior do olho, a retina é a estrutura responsável por captar a luz e convertê-la em sinais elétricos, que, ao chegarem ao cérebro, geram as imagens. Ela só começa a amadurecer nas últimas semanas da gravidez. Quando a criança nasce antes da 32ª semana de gestação ou com peso inferior a 1,5 quilo e precisa receber cuidados em Unidade de Terapia Intensiva (UTI), como a suplementação de oxigênio, a retina não amadurece bem. Com a retirada do oxigênio, os vasos sanguíneos que a nutrem às vezes passam a se proliferar de maneira exagerada, o que pode deixar cicatrizes no fundo do olho e levar à perda da visão. Conhecida com o nome de retinopatia da prematuridade, essa formação irregular de vasos é uma das principais causas de cegueira na infância – é o problema que levou o músico e cantor norte-americano Stevie Wonder a não enxergar.
Utilizando camundongos criados em condições semelhantes às de crianças recém-nascidas que passam um período em UTI, os bioquímicos Ricardo Giordano e Sayuri Miyamoto, ambos do Instituto de Química (IQ) da USP, e seus colaboradores identificaram agora alterações na disponibilidade de lipídios (gorduras) na retina e no uso desses compostos por ela. Os resultados, apresentados em um artigo publicado em junho na revista iScience, ajudam a compreender por que as células dessa estrutura do olho podem deixar de funcionar de maneira adequada na retinopatia da prematuridade.
À medida que a proliferação dos vasos avançou no experimento com os roedores, os bioquímicos Alex Inague e Lilian Alecrim, que, respectivamente, fazem doutorado sob a orientação de Miyamoto e Giordano, observaram uma alteração importante nas quantidades de 277 (92%) dos 300 tipos de lipídios naturalmente encontrados nas células da retina. Lipídios são moléculas orgânicas formadas por longas sequências de átomos de carbono (C), às quais se ligam hidrogênio (H), oxigênio (O), nitrogênio (N) e fósforo (P). Eles compõem diferentes tipos de óleos e gorduras e desempenham papéis fundamentais no funcionamento do organismo. São os principais componentes da membrana, o envoltório fluido que separa as organelas celulares do meio externo e controla a entrada de compostos nas células, além de funcionarem como fonte de energia. Também atuam como sinalizadores químicos, enviando informações tanto para o interior da célula como para outros tecidos.
Na retina, a disponibilidade dos lipídios e a atuação apropriada deles em reações químicas são ainda mais importantes. É que suas células, assim como as do coração e dos outros músculos, apresentam alto consumo de energia. Para se manterem ativas, elas consomem tanto a energia disponível nas moléculas de glicose como a armazenada por certos lipídios. Além disso, essas células sofrem degradação mais acelerada por interagirem com a luz e com moléculas de oxigênio e precisam substituir os lipídios danificados para permanecerem intactas e sobreviverem. Estima-se que, a cada dia, as células receptoras de luz (os chamados fotorreceptores) troquem até 10% dos lipídios da camada externa de sua membrana.
Inague e Alecrim mediram as concentrações de lipídios em diferentes estágios da retinopatia e observaram três fenômenos principais. O primeiro foi um aumento na retina doente da quantidade de lipídios neutros, moléculas apolares que, em geral, funcionam como reserva de energia – seus níveis eram ao menos três vezes mais elevados do que os encontrados no tecido saudável. Na retinopatia, os lipídios neutros também pareceram se agrupar no interior das células e formar gotículas, dentro das quais foram encontrados lipídios mais sensíveis à ação das moléculas de oxigênio. Tanto o aumento no nível desses lipídios quanto no da formação de gotículas foi corroborado pela expressão maior de genes que codificam proteínas associadas à síntese desses compostos e à organização dessas vesículas de gordura nas células. Em um trabalho publicado em 2015 na revista Cell, a equipe de Alex Gould, do Instituto Francis Crick, no Reino Unido, havia verificado que essas gotículas, ao abrigar os ácidos graxos mais flexíveis da membrana, protegiam-nos da ação danosa do oxigênio. “É como se, na enfermidade, a célula tentasse resguardar o seu material mais nobre”, conta Inague.
O terceiro fenômeno foi uma redução importante na disponibilidade de ácidos graxos dos tipos ômega-3 e ômega-6, acompanhada de um incremento significativo de ácidos graxos ômega-9. A redução desses compostos já era esperada, uma vez que o nascimento corta o suprimento que chegava ao bebê via placenta. Por essa razão, os médicos, às vezes, dão suplementação nutricional contendo ômega-3 e ômega-6 para tentar prevenir danos na retina. Os resultados, no entanto, nem sempre são satisfatórios. “Aparentemente há uma alteração no metabolismo que a suplementação não supre. Talvez, por isso, ela não seja completamente efetiva”, explica Miyamoto.
“Estudos como esse são importantes porque lançam luz sobre os mecanismos envolvidos no desenvolvimento da doença”, afirma a oftalmologista Eliane Chaves Jorge, da Faculdade de Medicina da Universidade Estadual Paulista (Unesp), especialista em retinopatia da prematuridade. “Os resultados mostram que na retinopatia ocorre uma remodelação lipídica [alteração na concentração, disponibilidade e uso dessas moléculas] que pode explicar por que a suplementação com ômega-3 e ômega-6 nem sempre tem o efeito esperado”, explica a médica.
Em 2019, a equipe de Giordano já havia analisado como evoluía a atividade dos genes – a chamada expressão gênica – nas células da retina de roedores com retinopatia da prematuridade. Na época, os pesquisadores identificaram um aumento na ativação de cerca de 3 mil genes, a maior parte deles associada à formação de novos vasos sanguíneos (angiogênese). “No primeiro trabalho, olhamos a expressão gênica, mas percebemos que ela não permitia explicar tudo o que se passava com as células da retina nessa enfermidade. Por isso, em seguida estudamos os lipídios. Agora estamos analisando o que ocorre com as proteínas”, conta Giordano. “Queremos entender tudo o que está acontecendo”, diz o bioquímico.
Projetos
1. Mecanismos moleculares da angiogênese e da heterogeneidade vascular (nº 19/25828-8); Modalidade Projeto Temático; Pesquisador responsável Ricardo Jose Giordano (IQ-USP); Investimento R$ 1.768.922,73.
2. Redoxoma (nº 13/07937-8); Modalidade Centros de Pesquisa, Inovação e Difusão (Cepid); Pesquisadora responsável Ohara Augusto (IQ-USP); Investimento R$ 62.754.313,69.
3. Mecanismos de detoxificação e reparo de membranas biológicas oxidadas envolvendo a ação da enzima peroxirredoxina 6 (nº 17/13804-1); Modalidade Bolsa de Doutorado Direto; Pesquisadora responsável Sayuri Miyamoto (IQ-USP); Bolsista Alex Inague; Investimento R$ 235.935,57.
Artigo científico
INAGUE, A. et al. Oxygen-induced pathological angiogenesis promotes intense lipid synthesis and remodeling in the retina. iScience. v. 26, n. 6. 16 jun. 2023.