À medida que envelhecem, os macacos-prego, um dos primatas mais inteligentes das Américas, podem apresentar no cérebro os mesmos tipos de lesão que caracterizam a doença de Alzheimer. Pesquisadores da Faculdade de Medicina da Universidade de São Paulo (FM-USP) e do Centro de Primatologia da Universidade de Brasília (UnB) identificaram em dois animais idosos – um de 29 e outro de 33 anos – tanto as placas de peptídeo beta-amiloide, formadas pelo acúmulo desses fragmentos de proteína ao redor dos neurônios, quanto os emaranhados neurofibrilares de proteína tau, que se concentram no interior dessas células e as matam. Nem as placas nem os emaranhados foram encontrados no cérebro de um animal adulto jovem, de 9 anos. Os achados foram publicados em março na revista Scientific Reports e podem, segundo os autores, abrir caminho para que os macacos-prego sejam adotados como um modelo natural para estudar a evolução e o tratamento da doença de Alzheimer, a forma mais comum de demência nos seres humanos (ver Pesquisa FAPESP nº 329).
A ideia de verificar se algo semelhante ao Alzheimer ocorria também em macacos-prego surgiu anos atrás, quando o neurologista Ricardo Nitrini, da FM-USP, estudioso da epidemiologia das demências no Brasil e um dos coordenadores da pesquisa, conheceu a psicóloga Maria Clotilde Tavares. Especialista em neurociência e comportamento, Tavares já coordenava o Centro de Primatologia da UnB, onde viviam os animais usados no estudo. “Esperamos a morte natural deles antes de realizar a avaliação do tecido cerebral”, relata Nitrini.
Com tamanho variando de 35 a 48 centímetros (sem a cauda) e pesando até 4,8 quilos, os macacos-prego (Sapajus libidinosus) estão entre os primatas não humanos mais comuns das Américas. No Brasil, vivem em praticamente todos os biomas, dos mais úmidos, como a Amazônia e a Mata Atlântica, aos mais secos, como o Cerrado e a Caatinga. Eles atraem o interesse de quem investiga o declínio cognitivo porque, além de abundantes, apresentam habilidades manuais e comportamentos mais sofisticados do que outros macacos, como o uso e a produção de ferramentas para caçar ou extrair castanhas, algo ensinado de uma geração para outra (ver as reportagens “Ferramenta masculina”, “Macacos-prego já usavam ferramentas no período pré-Colombiano” e Pesquisa FAPESP nº 259). A essas características, somam-se outros dois fatos. Neles, o tamanho do cérebro em relação ao do corpo – o chamado quociente de encefalização, um indicador de inteligência – é superior ao da maioria dos outros primatas não humanos, e eles têm o cérebro anatomicamente mais semelhante ao das pessoas, com dobras e sulcos, do que outras espécies de macacos, em particular as nativas do continente.
“Esses animais têm uma plasticidade comportamental muito grande e se adaptam a diferentes ambientes. Acredito que, com esse estudo, eles passarão a ser mais valorizados para a investigação das doenças neurológicas”, conta Tavares, da UnB. “Os macacos-prego têm uma vida longa, que pode chegar aos 40 anos em cativeiro. Isso deve permitir estudar como a degeneração cerebral afeta, com o tempo, as habilidades desses animais”, comenta o primatólogo Tiago Falótico, pesquisador e atual presidente da organização não governamental Neotropical Primates Research Group (NeoPReGo). Falótico investiga o uso de ferramentas e a evolução cultural dos macacos-prego e não participou do trabalho publicado na Scientific Reports, realizado com financiamento da FAPESP, do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), da Alzheimer’s Association e dos Institutos Nacionais de Saúde (NIH) dos Estados Unidos.
Até algum tempo atrás, os neurologistas e os neurocientistas supunham que a doença de Alzheimer fosse uma enfermidade exclusivamente humana, porque não se conheciam outros animais que apresentassem simultaneamente os dois tipos de lesão típicos dela. Essa ideia começou a mudar em 2008, quando a equipe do neurocientista Lary Walker, da Universidade Emory, nos Estados Unidos, relatou em um artigo publicado no The Journal of Comparative Neurology ter encontrado placas de peptídeos beta-amiloide e emaranhados de proteína tau no cérebro de um chimpanzé fêmea de 41 anos.
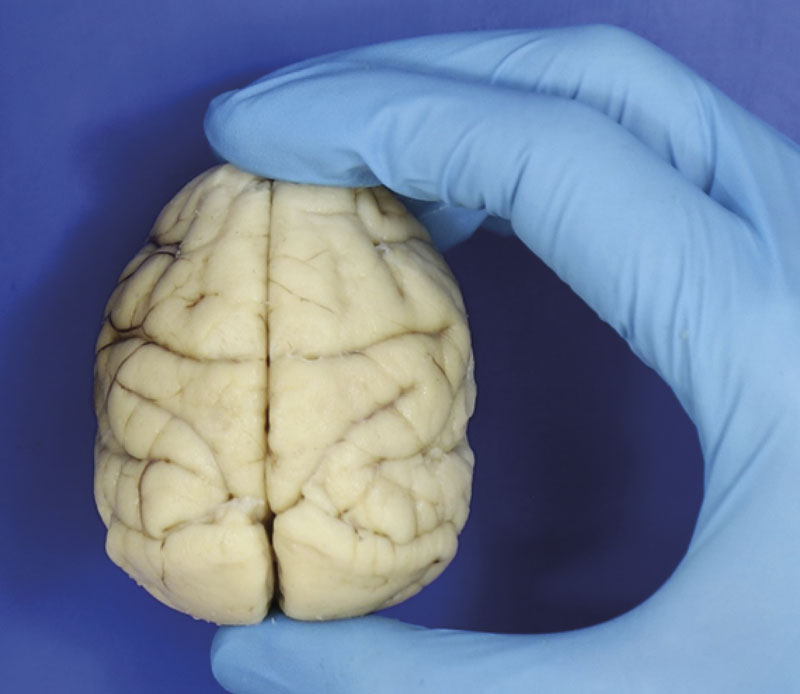
Roberta Diehl Rodriguez / USPAlto quociente de encefalização: macacos-prego têm cérebro (imagem real) proporcionalmente grande em relação ao corpoRoberta Diehl Rodriguez / USP
Originários da África, esses grandes símios são os primatas vivos evolutivamente mais próximos dos seres humanos. Ambos compartilharam um ancestral comum entre 7 milhões e 5 milhões de anos atrás e têm quase 99% do genoma idêntico. Por essa razão, do ponto de vista biológico, os chimpanzés pareciam um bom modelo para investigar a evolução e o tratamento de enfermidades que afligem o Homo sapiens, entre elas a doença de Alzheimer. Mas manter um chimpanzé em laboratório é caro – o custo passa dos US$ 20 mil por ano, segundo algumas estimativas – e esses animais correm risco de extinção (restam menos de 300 mil na natureza). Além disso, há pouco mais de uma década, as diretrizes de pesquisas com animais se tornaram mais rígidas (ver reportagem). As autoridades de saúde nos Estados Unidos e na Europa passaram a recomendar que os chimpanzés só fossem usados para investigar doenças humanas quando não existisse outro modelo disponível nem fosse possível, por impedimento ético, realizar os testes em pessoas.
Diante da impossibilidade de fazer certos experimentos com seres humanos, os pesquisadores têm avançado na compreensão dos fenômenos por trás do Alzheimer e na busca de potenciais tratamentos mais eficazes a partir de estudos iniciais com modelos nem sempre ideais. Os experimentos geralmente começam com cultura de células em laboratório, que permitem investigar o padrão de ativação de genes e as modificações nas vias bioquímicas que ocorrem na enfermidade, e avançam para os testes com roedores, quase sempre camundongos, capazes de revelar como a doença afeta alguns aspectos cognitivos. A variedade de modelos que já se tentou empregar para compreender como a doença se instala e evolui é grande. Inclui de vermes a moscas-da-fruta; de peixes a outros primatas, como lêmures e algumas espécies de macaco. Nenhum, porém, reproduz fiel e completamente o que ocorre no cérebro humano.
Os invertebrados, por exemplo, são vantajosos em certas situações, porque compartilham com os seres humanos alguns genes relevantes para a doença de Alzheimer e se reproduzem mais rapidamente do que os mamíferos. Mas, embora possam ser úteis para aprender sobre as vias bioquímicas afetadas na doença, não são ideais para estudar tratamentos porque nem sempre os efeitos que os compostos produzem neles são observados em animais com sistema nervoso mais complexo.
De longe os mais utilizados nas pesquisas, os roedores permitem observar alguns efeitos comportamentais da doença, como a perda da memória espacial, e certos benefícios de potenciais terapias. Mas não permitem reproduzir integralmente a enfermidade. “Camundongos e ratos não desenvolvem espontaneamente as placas de peptídeo beta-amiloide nem os emaranhados de proteína tau, embora o primeiro tipo de lesão ocorra naturalmente nos exemplares idosos de um roedor chamado degu, que vive no Chile”, conta o bioquímico Sergio Teixeira Ferreira, da Universidade Federal do Rio de Janeiro (UFRJ), que investiga as causas do Alzheimer.
Há pelo menos duas décadas, os pesquisadores tentam contornar essa limitação manipulando artificialmente os animais. Uma das estratégias é alterar geneticamente os roedores para que produzam placas de beta-amiloide ou emaranhados de tau. Outra, desenvolvida pelo grupo da UFRJ, consiste em injetar fragmentos (oligômeros) do peptídeo beta-amiloide diretamente no cérebro do camundongo. “Isso causa alterações muito parecidas com as da doença de Alzheimer, inclusive a perda de memória”, explica Ferreira.
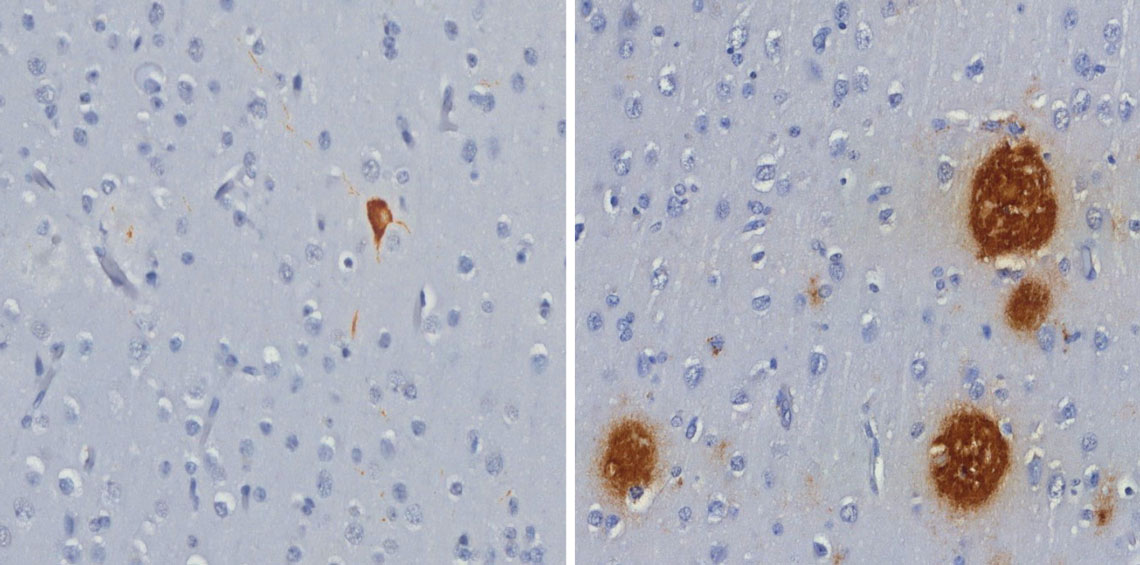
Roberta Diehl Rodriguez / USPEmaranhado de proteína tau (à esq.) e placas de peptídeo beta-amiloide (à dir.), ambos em marrom, encontrados no cérebro de macacos-pregoRoberta Diehl Rodriguez / USP
Mesmo assim, o que ocorre com os roedores pode ser bem diferente do que acontece no cérebro das pessoas. Os camundongos, por exemplo, só compartilham 85% do seu genoma com os seres humanos e têm um cérebro anatomicamente bem mais simples. Nos roedores, o órgão apresenta uma proporção maior de neurônios do que de outras células – no cérebro humano, a composição é de aproximadamente um para um. Essa diferença, estimam alguns pesquisadores, pode fazer a doença progredir nos animais de maneira distinta da que evolui nos seres humanos.
“Apesar do sucesso, os modelos bidimensionais de células e os modelos animais só conseguem capturar uma fração dos mecanismos da doença de Alzheimer, porque são incapazes de recapitular a estrutura, a função e a diversidade celular específicas do cérebro humano”, escreveram o bioengenheiro Donghui Zhu e colaboradores da Universidade Stony Brook, nos Estados Unidos, em um artigo de revisão publicado em 2022 na revista Bioengineering and Translational Medicine.
Uma maneira de diminuir a lacuna entre a doença humana e os modelos animais é usar espécies filogeneticamente mais próximas que desenvolvam espontaneamente a patologia típica do Alzheimer. “Trabalhar com modelos naturais permite observar um quadro mais realista, mais semelhante ao que acontece com os seres humanos”, afirma Analía Arévalo, neurocientista especialista em linguagem e pesquisadora do Laboratório de Pesquisa em Cirurgia Experimental da FM-USP, que não participou do estudo da Scientific Reports.
Mesmo entre os primatas, com arquitetura cerebral mais complexa do que os roedores e evolutivamente mais próximos dos seres humanos, ainda não se encontrou um modelo perfeito. Placas de peptídeo beta-amiloide já foram registradas em macacos rhesus (Macaca mulatta), macacos-cinomolgo (Macaca fascicularis), saguis-de-tufo-branco (Callithrix jacchus) e lêmures-rato-cinza (Microcebus murinus), mas nem sempre elas ocorrem simultaneamente aos emaranhados de proteína tau, embora os animais possam apresentar déficit cognitivo. Outra diferença está nas regiões cerebrais em que essas placas e emaranhados se formam. Nos seres humanos, elas ocorrem com mais frequência no hipocampo, área associada à aquisição e consolidação da memória, enquanto nos saguis e nos macacos rhesus são mais comuns em áreas associadas às emoções (sistema límbico) ou à audição (córtex temporal).
Nesses dois aspectos, os macacos-prego parecem oferecer um modelo mais próximo à doença humana: eles apresentaram as placas de beta-amiloide e os emaranhados de proteína tau, e essas lesões afetaram tanto o córtex quanto o hipocampo. Os pesquisadores ainda detectaram neles sinais de neuroinflamação, assim como ocorre nos seres humanos. “Nenhum outro primata do Novo Mundo usado nos estudos é tão inteligente como o macaco-prego, que fabrica as próprias ferramentas e consegue ficar em posição bípede por bastante tempo”, diz a neurocientista Roberta Diehl Rodriguez, primeira autora do estudo da Scientific Reports. “Além disso, é o primata do Novo Mundo que apresenta as alterações neuropatológicas mais similares às dos seres humanos”, afirma.
Para que os macacos-prego se tornem efetivamente um modelo da doença de Alzheimer, porém, os pesquisadores precisarão confirmar a ocorrência das lesões em um número maior de animais e caracterizar como elas afetam o comportamento. “Esse seria o aspecto mais interessante a ser comparado com o perfil da doença nos seres humanos”, pondera Arévalo.
Ainda que dê certo, há uma limitação. A progressão da doença nesses animais pode levar décadas. Para superar o problema, na UFRJ, o grupo da neurocientista Fernanda De Felice busca um modelo artificial de Alzheimer em primatas jovens. Há 10 anos, ela e colaboradores da Queen’s University, no Canadá, conseguiram reproduzir no cérebro de macacos-cinomolgo, também ameaçados de extinção, os danos que o Alzheimer causa em humanos por meio da injeção no cérebro dos animais de oligômeros de beta-amiloide, que se acumulam no córtex frontal, no hipocampo e em outras áreas associadas à memória e a aspectos cognitivos (ver Pesquisa FAPESP nº 225). Mais recentemente, o grupo induziu o surgimento das lesões em macacos rhesus jovens, com 3 a 5 anos de idade, para não ter de esperar a evolução natural do Alzheimer. “Conseguir reproduzir a doença em animais jovens”, conta Ferreira, da UFRJ, marido e colaborador de De Felice, “facilitaria muito o trabalho”.
A reportagem acima foi publicada com o título “Um potencial modelo para o Alzheimer” na edição impressa nº 341, de julho de 2024.
Projeto
Caracterização da astrogliopatia por tau no envelhecimento e em doenças neurodegenerativas (nº 16/24326-0); Modalidade Bolsa de Pós-doutorado; Pesquisador responsável Ricardo Nitrini (USP); Bolsista Roberta Diehl Rodriguez; Investimento R$ 301.733,62.
Artigos científicos
RODRIGUEZ, R. D. et al. Bearded capuchin monkeys as a model for Alzheimer’s disease. Scientific Reports. 15 mar. 2024.
ROSEN, R. F. et al. Tauopathy with paired helical filaments in an aged chimpanzee. The Journal of Comparative Neurology. 14 mai. 2008.
SREENIVASAMURTHY, S. et al. Current progress of cerebral organoids for modeling Alzheimer’s disease origins and mechanisms. Bioengineering and Translational Medicine. 29 jul. 2022.
