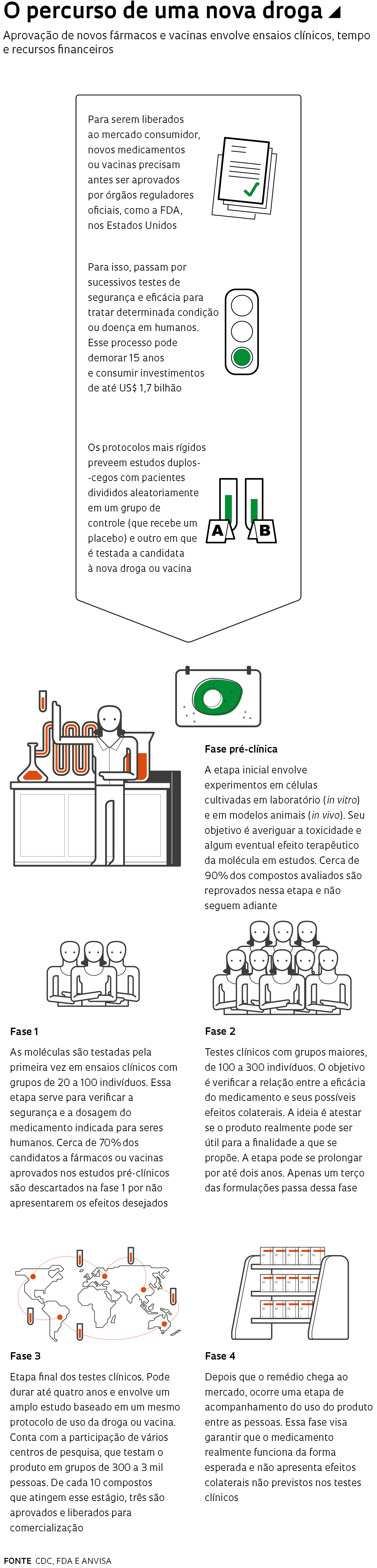
Em um esforço para acelerar a coleta e o compartilhamento de dados sobre terapias que possam ser usadas em pessoas infectadas com o novo coronavírus (Sars-CoV-2), causador da Covid-19, a Organização Mundial da Saúde (OMS) lançou, no final de março, um estudo global, com pacientes de diversos países, para testar os fármacos que se mostraram mais promissores até agora contra a doença. Antes de serem liberados ao mercado consumidor, novos remédios ou vacinas precisam ser aprovados por órgãos reguladores oficiais. Para isso, precisam passar por vários testes que comprovem sua segurança e eficácia em seres humanos. Uma das estratégias para acelerar esse processo é avaliar os efeitos terapêuticos de medicamentos clinicamente aprovados e já usados contra outras doenças.
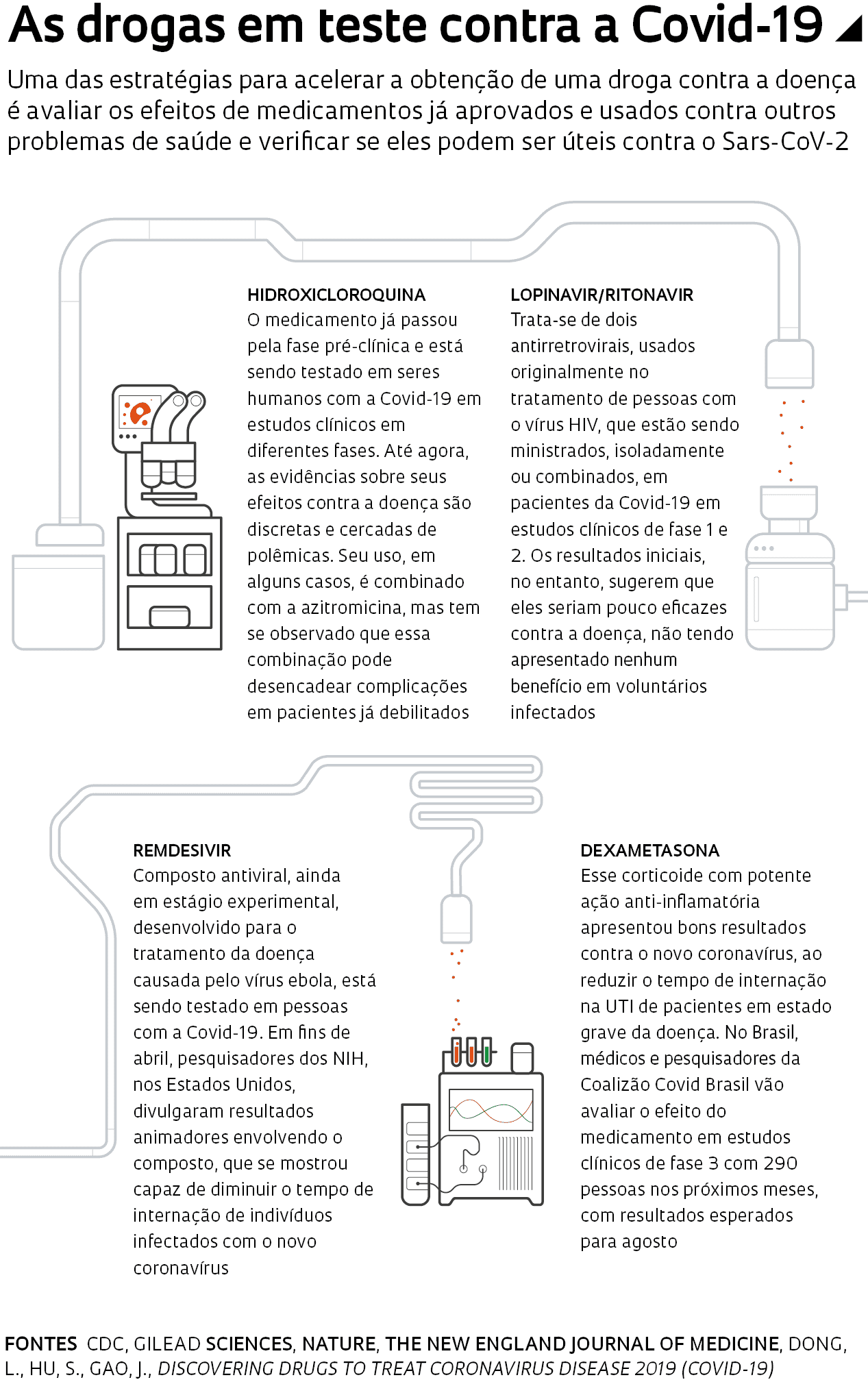
Estima-se que até 70 fármacos, entre compostos disponíveis no mercado e drogas experimentais, tenham algum efeito sobre o novo coronavírus. Um deles é a hidroxicloroquina, droga derivada da cloroquina, usada originalmente no tratamento da malária. O medicamento ganhou grande destaque após a divulgação de resultados aparentemente promissores, mas preliminares, de estudos feitos com pacientes que receberam a droga na França e na China. Esses trabalhos, conduzidos às pressas em meio à pandemia, sem o rigor científico habitual, reverberaram com ainda mais força após o presidente norte-americano, Donald Trump, ter afirmado que a agência regulatória de alimentos e medicamentos dos Estados Unidos, a FDA, havia aprovado o uso da hidroxicloroquina em pessoas infectadas. No Brasil, o presidente Jair Bolsonaro, mesmo sem evidências, também promoveu o uso do fármaco contra a Covid-19.
Estudos recentes, porém, apontam para um cenário menos animador. Há indícios de que o uso da hidroxicloroquina em indivíduos com Covid-19 possa desencadear reações adversas graves, sobretudo quando administrada com outras drogas, em pessoas com doenças renais ou cardíacas preexistentes. As evidências fizeram com que a FDA divulgasse um comunicado no dia 24 de abril manifestando preocupação quanto ao uso da droga em pacientes com Covid-19. A agência recomendou que ela seja usada apenas em ensaios clínicos ou hospitais, de modo que os pacientes sejam monitorados de perto por uma equipe médica.
A principal suspeita é a de que a hidroxicloroquina aumente o risco de complicações como arritmia cardíaca, alteração na frequência dos batimentos do coração que pode causar desde mal-estar até parada cardíaca. No Brasil, um estudo realizado em Manaus por pesquisadores de diversas instituições do país para avaliar o uso de duas dosagens do medicamento, uma mais baixa e outra mais alta, em pacientes com Covid-19, precisou ser interrompido após 11 participantes morrerem. Parte deles havia recebido doses mais altas do fármaco, o que pode ter desencadeado complicações cardíacas fatais. Outro estudo publicado em abril no repositório medRxiv avaliou o uso da hidroxicloroquina em 368 homens com Covid-19, dos quais 97 receberam hidroxicloroquina, 113 hidroxicloroquina e azitromicina e 158 outro tratamento. Verificou-se que 27% dos pacientes tratados com hidroxicloroquina e 22% dos que receberam a terapia combinada morreram. Já a taxa de mortalidade do grupo que não usou nenhum dos medicamentos foi de 11,4%.
Reuters/Fotoarena
Em laboratório, pesquisadores avaliam os efeitos da hidroxicloroquina em amostras do novo coronavírus
Reuters/FotoarenaA hidroxicloroquina é uma versão menos tóxica da cloroquina, medicação desenvolvida em 1934 e usada na prevenção e no tratamento de casos de malária. O interesse em torno da droga nasceu da repercussão de uma carta publicada por pesquisadores chineses em março na revista BioScience Trends, sugerindo que o fármaco seria capaz de inibir a proliferação do Sars-CoV-2 em pessoas infectadas. “O problema é que os autores não divulgaram os dados que dão suporte às suas afirmações, de modo que é impossível reproduzi-los ou mesmo avaliar se os achados fazem sentido”, diz o médico Marcelo Urbano Ferreira, do Instituto de Ciências Biomédicas da Universidade de São Paulo (ICB-USP).
As expectativas em torno do fármaco foram reforçadas mais tarde por um estudo controverso com 36 pessoas com Covid-19 publicado na revista International Journal of Antimicrobial Agents. Nele, pesquisadores franceses afirmam ter obtido resultados promissores envolvendo seu uso em indivíduos com a doença. O trabalho avaliou a eficácia da hidroxicloroquina quando administrada sozinha e em conjunto com a azitromicina em pacientes internados em um hospital de Marselha, sul da França. Na avaliação do farmacologista Gustavo Batista de Menezes, do Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais (UFMG), o estudo francês esconde falhas que enfraquecem seus resultados. “O trabalho peca em praticamente todos os requisitos básicos de um bom ensaio clínico”, afirma.
Apesar da polêmica, alguns hospitais do mundo incorporaram, de forma experimental, a hidroxicloroquina no tratamento de indivíduos com Covid-19. No Brasil, a operadora de plano de saúde Prevent Senior iniciou, no dia 26 de março, testes com a hidroxicloroquina e a azitromicina em 412 pacientes com a doença em um de seus hospitais na capital paulista. Os resultados preliminares, divulgados dia 17 de abril, sugeriam que a estratégia havia reduzido o número de internações. O problema é que a operadora iniciou os testes antes de ter recebido autorização da Comissão Nacional de Ética em Pesquisa (Conep) e não tinha confirmação laboratorial de que os pacientes realmente tinham sido infectados pelo Sars-CoV-2. A situação levou o Conep a suspender o estudo.
Segundo Marcelo Ferreira, as controvérsias em torno da hidroxicloroquina reforçam a necessidade de estudos mais robustos para avaliar se a droga é realmente segura e eficaz contra a Covid-19. “Essas pesquisas também ajudarão a estimar os efeitos colaterais associados à administração da medicação em pessoas com a doença”, diz o biólogo Cláudio Marinho, do ICB-USP.
Antivirais e anticorpos monoclonais
Embora o controverso uso do antimalárico contra a Covid-19 tenha monopolizado boa parte das discussões públicas, outros compostos, em especial os antivirais, também estão sendo testados contra a doença. Um deles é o remdesivir, ainda em estágio experimental, desenvolvido pela empresa norte-americana Gilead Sciences para o tratamento do ebola. Em março, a empresa anunciou o início de estudos clínicos para avaliar sua eficácia e segurança em quase mil pessoas. Além da OMS e da Gilead Sciences, pesquisadores de instituições públicas estudam o potencial do fármaco em pessoas infectadas. No dia 29 de abril, cientistas do Instituto Nacional de Alergia e Doenças Infecciosas, um dos Institutos Nacionais de Saúde (NHI) dos Estados Unidos, divulgaram resultados preliminares animadores com o remdesivir. No teste, feito com 1.063 voluntários hospitalizados com Covid-19, as pessoas tratadas com o composto ficaram menos tempo internadas do que as que receberam placebo.
Dois outros fármacos na mira dos pesquisadores são o lopinavir e o ritonavir, antirretrovirais usados em conjunto contra o vírus HIV. Há ainda o anti-inflamatório corticoide dexametasona, que pode causar muitos efeitos colaterais e não deve ser tomado sem recomendação médica. No Brasil, médicos e pesquisadores da Coalizão Covid Brasil preparam-se para avaliar esses medicamentos em estudos clínicos com 290 pessoas nos próximos meses, com resultados esperados para agosto. A coalizão foi lançada em março e envolve os hospitais Albert Einstein, Hospital do Coração (HCor) e Sírio-Libanês, além da Rede Brasileira de Pesquisa em Terapia Intensiva (BRICNet).
Os pesquisadores também investem em terapias capazes de diminuir a alta concentração de citocinas inflamatórias observada em pessoas em estado grave da Covid-19. Não raro, os indivíduos nessas condições apresentam níveis elevados de uma proteína chamada interleucina-6 (IL-6) no sangue. Seu acúmulo pode desencadear complicações e levar à morte. Estudos sugerem que o Actemra (tocilizumab), anticorpo monoclonal produzido pela farmacêutica Roche, agiria como um inibidor da IL-6. O medicamento, usado contra a artrite reumatoide, já está sendo administrado em pacientes com Covid-19 na China. Em março, nos Estados Unidos, a FDA autorizou a Roche a iniciar ensaios clínicos com a Actemra em 300 pacientes com a doença hospitalizados com pneumonia. As farmacêuticas Sanofi e a Regeneron também pretendem avaliar a Kevzara (sarilumab), outro inibidor da IL-6, em pacientes em estado grave.
Plasma
Hospitais e universidades do mundo se articulam para usar o plasma de pessoas que se curaram da Covid-19 em indivíduos com a doença. O plasma é a parte líquida do sangue e constitui cerca de 60% de seu conteúdo total. Seu uso tem sido considerado uma possível estratégia para fornecer os anticorpos neutralizantes necessários para aqueles que ainda não os têm em níveis capazes de protegê-los da Covid-19. Embora não seja um processo isento de riscos, estima-se que a transfusão de plasma possa levar à diminuição da carga viral no organismo e à melhora dos sintomas, ou à evolução clínica dos pacientes.
A estratégia já foi usada várias vezes ao longo da história em surtos de outras infecções respiratórias, inclusive em epidemias recentes causadas por outros vírus da família coronavírus, como as epidemias da Síndrome Aguda Respiratória (Sars), em 2003, e a da Síndrome Respiratória do Oriente Médio (Mers), em 2012. No Brasil, o Centro de Hematologia e Hemoterapia da Universidade Estadual de Campinas (Unicamp) deverá em breve iniciar a coleta de plasma de pessoas que se curaram da Covid-19 e usá-lo no tratamento de indivíduos com a doença no Hospital de Clínicas da Faculdade de Ciências Médicas (FCM) da universidade e também em outros hospitais da região. No início de abril, um consórcio envolvendo os hospitais Albert Einstein e Sírio-Libanês e a FM-USP já havia recebido autorização para iniciar os testes com plasma em pessoas infectadas com o novo coronavírus em estado grave. Também o Hemocentro de Ribeirão Preto iniciou a coleta do plasma de pacientes curados da Covid-19 para tratamento de indivíduos em estado crítico da doença no Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da USP.
“Tudo indica que levará um tempo até que tenhamos um tratamento seguro e eficaz contra a Covid-19”, comenta Menezes. “Isso porque, para ser testado adequadamente, essas estratégias precisam primeiro passar por bons ensaios clínicos, o que demanda tempo e recursos, humanos e financeiros.”
Vacinas são testadas em humanos Seis das mais de 70 formulações em desenvolvimento atingiram as fases iniciais de testes clínicosPelo menos 76 candidatas a vacinas contra a Covid-19 surgiram desde o início da pandemia, segundo dados da OMS. No entanto, apenas seis conseguiram, até agora, avançar para as fases de testes em seres humanos. A mais recente a atingir esse estágio foi a formulação desenvolvida pela empresa norte-americana Pfizer, em parceria com a alemã BioNTech. No dia 22 de abril, o Instituto Paul-Ehrlich, órgão regulador médico da Alemanha, autorizou o início dos ensaios de fase 1 e 2 com o imunizante.
A tecnologia empregada na vacina baseia-se no uso de moléculas sintéticas de RNA mensageiro (mRNA) do Sars-CoV-2. Elas contêm a receita química para a produção da proteína S, usada pelo vírus para se conectar às células humanas. A ideia é que, dentro das células, essas moléculas estimulem uma resposta imunológica que prepare o organismo para combater o vírus real. O imunizante será testado em cerca de 200 pessoas saudáveis com idade entre 18 e 55 anos nos próximos meses. As empresas aguardam a autorização da FDA para iniciar testes clínicos também nos Estados Unidos.
A primeira candidata à vacina contra o novo coronavírus a chegar à fase 2 de testes clínicos foi criada pela empresa chinesa CanSino, em parceria com o Instituto de Biotecnologia de Pequim. A formulação usa adenovírus tipo 5 geneticamente modificado para carregar moléculas sintéticas de mRNA do Sars-CoV-2. Essa estratégia também foi usada por pesquisadores da Universidade de Oxford, no Reino Unido, para desenvolver outro imunizante contra a Covid-19. Ele está sendo testado em 1.110 voluntários desde fins de abril.
Desde o dia 16 de março, uma equipe do Kaiser Permanente, instituto de pesquisa em saúde de Seattle, nos Estados Unidos, trabalha com a empresa de biotecnologia Moderna em ensaios clínicos de fase 1 com 45 pessoas para testar uma candidata à vacina igualmente baseada em mRNA do Sars-Cov-2. Concebido pela empresa chinesa Sinovac Biotech, outro potencial imunizante se encontra na fase 1 dos testes. A vacina, que se baseia em uma versão quimicamente inativada do Sars-CoV-2, foi a primeira a produzir imunidade em animais e agora está sendo avaliada em 144 voluntários da província de Jiangsu, na China.
A sexta formulação em testes em humanos é a desenvolvida pela companhia norte-americana Inovio Pharmaceuticals. A vacina começou a ser aplicada em humanos em ensaios de fase 1 no começo de abril e usa uma estratégia semelhante à do mRNA do Sars-CoV-2.
No Brasil, a busca por uma vacina ainda está na fase de estudos pré-clínicos, em modelos animais. Pesquisadores da Fundação Oswaldo Cruz (Fiocruz) de Minas Gerais tentam modificar o vírus influenza A (H1N1), causador da gripe, para que ele carregue trechos do material genético do Sars-CoV-2 e induza uma resposta imunológica do organismo. Já o grupo do Laboratório de Imunologia do Instituto do Coração da FM-USP optou por uma abordagem diferente para tentar ativar as células de defesa contra o Sars-CoV-2. Eles pretendem combinar VLPs – partículas com características semelhantes às de um vírus, normalmente reconhecidas como um agente invasor pelo organismo – e antígenos produzidos pelo novo coronavírus para averiguar se a estratégia é capaz de produzir anticorpos contra o Sars-CoV-2.
Artigos científicos
MAGAGNOLI, J. et al. Outcomes of hydroxychloroquine usage in United States veterans hospitalized with Covid-19. medRxiv. abr. 2020.
CAO, B. et al. A trial of lopinavir–ritonavir in adults hospitalized with severe Covid-19. The New England Journal of Medicine. mar. 2020.
GAO, J., TIAN, Z. & YANG, X. Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of Covid-19 associated pneumonia in clinical studies. Biosci Trends. v. 14, n. 1, p. 72-3. mar. 2020.
GAUTRET, P. et al. Hydroxychloroquine and azithromycin as a treatment of Covid-19: Results of an open-label non-randomized clinical trial. International Journal of Antimicrobial Agents. mar. 2020.
HU, T. Y., FRIEMAM, M. & WOLFRAM, J. Insights from nanomedicine into chloroquine efficacy against Covid-19. Nature Nanotechnology. mar. 2020.
WANG, M. et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res. v. 30, n. 3, p. 269-71. mar 2020.
ZHOU F, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. The Lancet. mar. 2020.
Republicar