En un esfuerzo para acelerar el recabado y el intercambio de datos sobre terapias que puedan utilizarse en pacientes infectados con el nuevo coronavirus (Sars-CoV-2), causante de la enfermedad denominada covid-19, la Organización Mundial de la Salud (OMS) puso en marcha, hacia el final de marzo, un estudio global con pacientes de diversos países para testear los fármacos que, por ahora, se han mostrado más prometedores contra la enfermedad. Antes de que pueda liberárselos para el mercado de consumo, los nuevos remedios o vacunas deben ser aprobados por los organismos reguladores oficiales. Para ello, deben pasar varias pruebas que comprueben su seguridad y eficacia en seres humanos (vea la infografía). Una de las estrategias para acelerar ese proceso consiste en evaluar los efectos terapéuticos de medicamentos clínicamente aprobados y ya utilizados contra otras enfermedades.
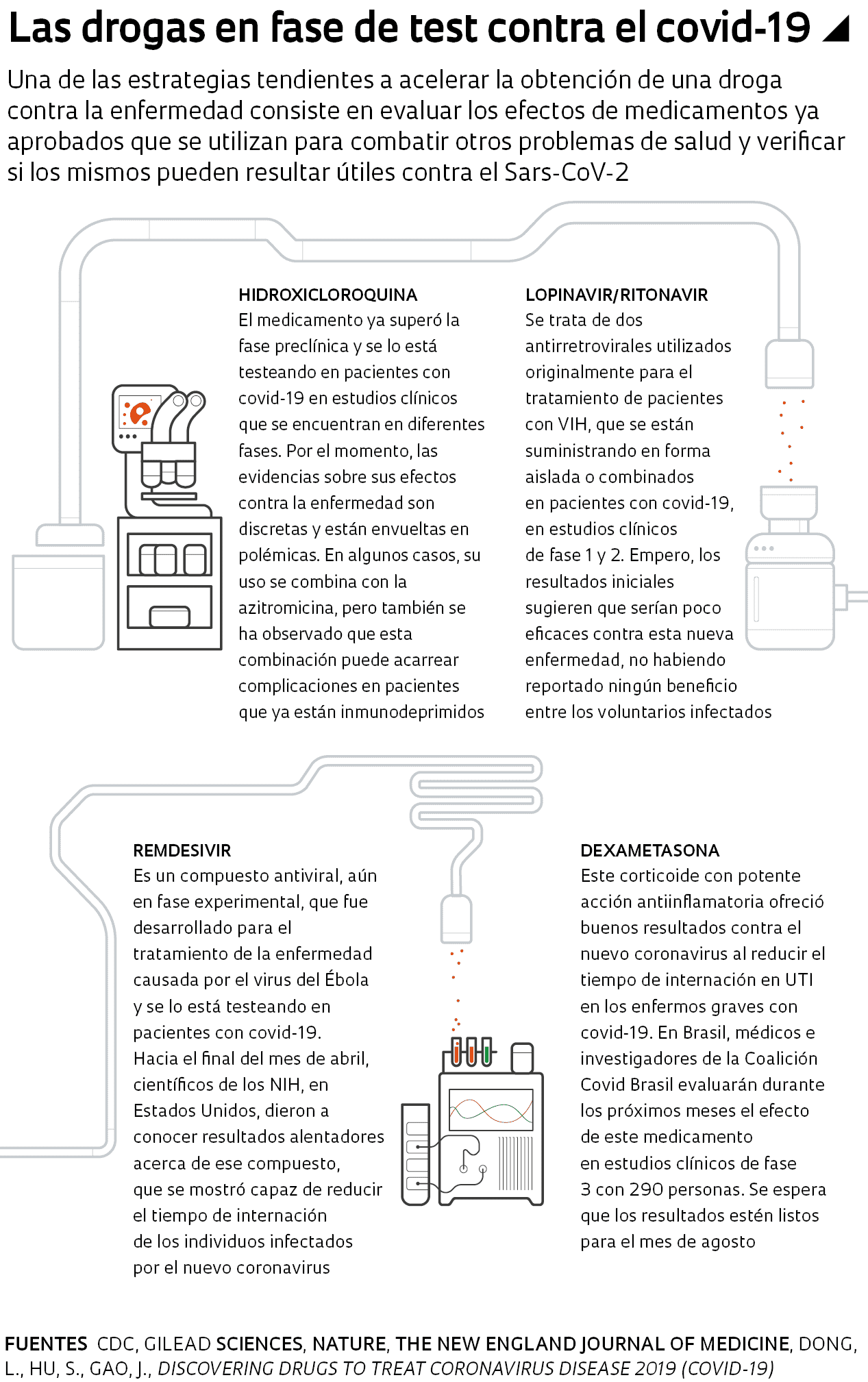
Se estima que hay unos 70 fármacos, entre compuestos disponibles en el mercado y drogas experimentales, que tienen algún efecto sobre el nuevo coronavirus. Uno de ellos es la hidroxicloroquina, una droga derivada de la cloroquina, que se utiliza originalmente para el tratamiento del paludismo. Este medicamento cobró relevancia cuando se divulgaron resultados aparentemente prometedores, aunque preliminares, de estudios llevados a cabo con pacientes con los que se utilizó esa droga en Francia y en China. Esos trabajos, realizados con premura en medio de la difusión de la pandemia, sin la rigurosidad científica habitual, resonaron aún con mayor fuerza luego de que el presidente estadounidense Donald Trump afirmó que la agencia que regula los alimentos y medicamentos de Estados Unidos, la FDA, había aprobado el uso de la hidroxicloroquina en los pacientes infectados. En Brasil, el presidente Jair Bolsonaro, incluso sin disponer de evidencias, también promovió el uso del fármaco contra el covid-19.
[box_latera]Lea más:
– El contraataque de la ciencia
– Una enfermedad aterradora
– Avanza la vacuna contra el dengue en Brasil
– Respiradores vitales
– En la palma de la mano
– Michel Nussenzweig: Un cazador de anticuerpos
– Una vulnerabilidad histórica
[/box_lateral]
Sin embargo, estudios recientes apuntan un escenario menos alentador. Existen indicios de que el uso de la hidroxicloroquina en pacientes con covid-19 puede desencadenar reacciones adversas graves, en particular si se la suministra junto con otras drogas, en personas con enfermedades renales o cardíacas preexistentes. Las evidencias motivaron que la FDA difundiese el 24 de abril un comunicado donde manifiesta su preocupación en cuanto al uso de la droga en los pacientes con covid-19. La agencia recomendó que se la utilice solamente en ensayos clínicos u hospitales, de manera tal que un equipo médico pueda monitorear de cerca a los pacientes.
La sospecha principal indica que la hidroxicloroquina aumenta el riesgo de complicaciones tales como arritmia cardíaca, una alteración en la frecuencia de los latidos del corazón que puede ocasionar desde un simple malestar hasta un paro cardíaco. En Brasil, un estudio que realizaron científicos de diversas instituciones del país en la ciudad de Manaos, para evaluar el uso de dos dosis distintas del medicamento, una más baja y otra más alta, en pacientes con covid-19, debió interrumpirse tras la muerte de 11 participantes. Algunos de ellos habían recibido las dosis más altas del fármaco, que podrían haber desencadenado complicaciones cardíacas fatales. En otro estudio que salió publicado en abril en el repositorio medRxiv se evaluó el uso de la hidroxicloroquina en 368 pacientes con covid-19, de los cuales 97 recibieron únicamente hidroxicloroquina, 113 hidroxicloroquina sumada al medicamento azitromicina y 158, otro tratamiento. Se comprobó que un 27% de los pacientes tratados con hidroxicloroquina y un 22% de los que recibieron la terapia combinada fallecieron. En tanto, la tasa de mortalidad para el grupo en el que no se utilizó ninguno de esos dos medicamentos fue del 11,4%.
Reuters/ Fotoarena
En laboratorio, los investigadores evalúan los efectos de la hidroxicloroquina en muestras del nuevo coronavirus
Reuters/ FotoarenaLa hidroxicloroquina es una versión menos tóxica de la cloroquina, un fármaco desarrollado en 1934 que se utiliza para la prevención y el tratamiento de los casos de paludismo. El interés en torno de esta droga se suscitó a partir de la repercusión de una carta publicada en marzo en la revista BioSciente Trends por científicos chinos, en donde se sugería que el medicamento sería capaz de inhibir la proliferación del Sars-CoV-2 en las personas infectadas. “El problema reside en que los autores no divulgaron los datos que brindan sustento a sus afirmaciones, de manera tal que resulta imposible reproducirlos o tan siquiera evaluar si los hallazgos tienen sentido”, dice el médico Marcelo Urbano Ferreira, del Instituto de Ciencias Biomédicas de la Universidad de São Paulo (ICB-USP).
Las expectativas en torno al fármaco fueron reforzadas posteriormente por un estudio controvertido que se llevó a cabo con 36 personas con covid-19 y que salió publicado en la revista International Journal of Antimicrobial Agents. En él, científicos franceses sostienen que obtuvieron resultados prometedores mediante su uso en pacientes afectados por la enfermedad. El trabajo evaluó la eficacia de la hidroxicloroquina cuando se la suministraba sola y también en conjunto con la azitromicina en pacientes internados en un hospital de Marsella, en el sur de Francia. A juicio de del farmacólogo Gustavo Batista de Menezes, del Instituto de Ciencias Biológicas de la Universidad Federal de Minas Gerais (UFMG), el estudio francés oculta fallas que debilitan sus resultados. “Ese trabajo no cumple prácticamente ninguno de los requisitos básicos de un buen ensayo clínico”, sostiene.
Pese a la polémica, algunos hospitales del mundo incorporaron la hidroxicloroquina en forma experimental para el tratamiento de pacientes con covid-19. En Brasil, la empresa operadora de planes de salud Prevent Senior dio inicio, el 26 de marzo, a la realización de test con hidroxicloroquina y azitromicina en 412 pacientes con la enfermedad en uno de sus hospitales en la capital paulista. Los resultados provisorios, divulgados el 17 de abril, sugerían que la estrategia había reducido la cifra de internaciones. El problema reside en que la operadora comenzó con las pruebas antes de haber recibido la correspondiente autorización de la Comisión Nacional de Ética en la Investigación Científica (Conep, en portugués) y no poseía tampoco la confirmación de laboratorio de que los pacientes realmente estuvieran infectados por el Sars-CoV-2. Esa situación motivó que la Conep suspendiera el estudio.
Según Marcelo Ferreira, las controversias en torno a la hidroxicloroquina refuerzan la necesidad de efectuar estudios más sólidos para evaluar si la droga es realmente segura y eficaz contra el covid-19. “Esas investigaciones también ayudarán a estimar los efectos colaterales asociados al suministro de la medicación a las personas afectadas por la enfermedad”, dice el biólogo Cláudio Marinho, del ICB-USP.
Antivirales y anticuerpos monoclonales
Aunque el controvertido uso del medicamento antipalúdico contra el covid-19 haya acaparado buena parte de los debates públicos, también se están probando otros compuestos en el tratamiento de la enfermedad, especialmente antivirales. Uno de ellos es el remdesivir, aún en fase experimental, desarrollado por la empresa estadounidense Gilead Sciences para el tratamiento del ébola. En marzo, la compañía anunció el inicio de los estudios clínicos con miras evaluar su eficacia y seguridad en una muestra de casi mil individuos. Por otra parte, además de los estudios que llevan adelante la OMS y Gilead Sciences, científicos de instituciones públicas también evalúan el potencial del fármaco con personas infectadas. El 29 de abril, científicos del Instituto Nacional de Alergia y Enfermedades Infecciosas, uno de los Institutos Nacionales de Salud (NIH) de Estados Unidos, divulgaron resultados preliminares alentadores con ese fármaco. En un test realizado con 1.063 voluntarios hospitalizados con covid-19, las personas tratadas con ese compuesto requirieron menos tiempo de internación que las que solamente recibieron un placebo.
Otros dos fármacos que están en la mira de los investigadores son el lopinavir y el ritonavir, antirretrovirales que se utilizan juntos contra el VIH. También figura el antiinflamatorio corticoide dexametasona, que puede ocasionar muchos efectos colaterales y no debe tomarse sin prescripción médica. En Brasil, los médicos e investigadores de la Coalición Covid Brasil se aprestan a evaluar esos medicamentos en estudios clínicos con 290 personas en los próximos meses, cuyos resultados se estima que estarán listos en agosto. La coalición se conformó en el mes de marzo e involucra al hospital Albert Einstein, al Hospital do Coração (HCor) y al Sírio-Libanês, aparte de la Red Brasileña de Investigación en Terapia Intensiva (BRICNet).
Los científicos también están trabajando en terapias capaces de disminuir la alta concentración de citoquinas inflamatorias que se observa en los pacientes graves con covid-19. No es raro que los individuos en esas condiciones registren niveles elevados de una proteína denominada interleuquina-6 (IL-6) en la sangre. Su acumulación puede desencadenar complicaciones e incluso conducir a la muerte. Hay estudios que sugieren que el medicamento conocido como Actemra (tocilizumab), un anticuerpo monoclonal producido por la compañía farmacéutica Roche, actuaría como inhibidor de la IL-6. Ese compuesto, que se emplea contra la artritis reumatoide, ya se les está suministrando a pacientes con covid-19 en China. En marzo, en Estados Unidos, la FDA autorizó a Roche para que inicie ensayos clínicos con el Actemra en 300 pacientes con la enfermedad hospitalizados por neumonía. Las empresas farmacéuticas Sanofi y Regeneron también pretenden evaluar el Kevzara (sarilumab), otro inhibidor de la IL-6, en pacientes en estado grave.
Plasma
Hospitales y universidades de todo el mundo trabajan en articulación para utilizar el plasma de las personas que se curaron de covid-19 en pacientes con esa misma enfermedad. El plasma es la parte líquida de la sangre y constituye alrededor del 60% de su contenido total. Su uso se ha considerado como una estrategia posible para proveer los anticuerpos neutralizantes necesarios para aquellos que aún no los poseen en un nivel capaz de protegerlos del covid-19. Si bien no es un proceso que esté exento de riesgos, se estima que la transfusión de plasma podría llevar a una disminución de la carga viral en el organismo y a una merma de los síntomas, o bien a la evolución clínica de los pacientes.
Esta estrategia ya se ha aplicado varias veces a lo largo de la historia en los casos de brotes de otras infecciones respiratorias, incluso en epidemias recientes causadas por otros virus de la familia de los coronavirus, tales como las epidemias del Síndrome Respiratorio Agudo Grave (Sars), en 2003, y del Síndrome Respiratorio de Oriente Medio (Mers), en 2012. En Brasil, el Centro de Hematología y Hemoterapia de la Universidad de Campinas (Unicamp) comenzará en breve a recolectar plasma de personas que se curaron del covid-19 y lo utilizará en el tratamiento de los pacientes enfermos en el Hospital de Clínicas de la Facultad de Ciencias Médicas (FCM) de la universidad, como así también en otros hospitales de la zona. Al comienzo de abril, un consorcio que abarca al Hospital Albert Einstein, al Sirio-Libanês y a la FM-USP ya había sido autorizado para iniciar los test con plasma en los pacientes graves infectados con el nuevo coronavirus. El Hemocentro de Ribeirão Preto también comenzó a recibir plasma de personas curadas del covid-19 para el tratamiento de pacientes de esa enfermedad en estado crítico internados en el Hospital de Clínicas de la Facultad de Medicina de Ribeirão Preto de la USP.
“Todo apunta a que pasará un tiempo hasta que podamos disponer de un tratamiento seguro y eficaz contra el covid-19”, comenta Menezes. “Sucede que, para poder testearlas en forma adecuada, esas estrategias deben pasar primero por buenos ensayos clínicos, algo que demanda tiempo y recursos, tanto humanos como económicos”.
Las vacunas que se están testeando en humanos Seis de las más de 70 fórmulas en desarrollo llegaron a las fases iniciales de ensayos clínicosSegún datos que registra la OMS, desde el inicio de la pandemia surgieron al menos 76 candidatas a vacunas contra el covid-19. Sin embargo, hasta ahora tan solo seis consiguieron progresar hasta las fases de ensayos en seres humanos. La más reciente en alcanzar esta etapa fue una fórmula desarrollada por la empresa farmacéutica estadounidense Pfizer, en colaboración con la alemana BioNTech. El 22 de abril, el Instituto Paul Erlich, el ente regulador médico de Alemania, autorizó el comienzo de los ensayos de las fases 1 y 2 con el agente inmunizante.
La tecnología que emplea esa vacuna se basa en el uso de moléculas sintéticas de ARN mensajero (ARNm) del Sarse-CoV-2. Estas contienen la fórmula química para la producción de la proteína S que el virus utiliza para adosarse a las células humanas. La idea es que, en el interior de las células, esas moléculas estimulen una respuesta inmunológica que prepare al organismo para combatir al virus real. El inmunizante será testeado durante los próximos meses con alrededor de 200 personas sanas con edades comprendidas entre 18 y 55 años. Las empresas aguardan la autorización de la FDA para dar comienzo a los ensayos clínicos también en Estados Unidos.
La primera candidata a vacuna contra el nuevo coronavirus en llegar a la fase 2 de los test clínicos fue creada por la empresa china CanSino, en colaboración con el Instituto de Biotecnología de Pekín. El compuesto utiliza adenovirus tipo 5 modificado genéticamente para cargar moléculas sintéticas de ARNm del Sars-CoV-2. Esta estrategia también fue empleada por científicos de la Universidad de Oxford, en el Reino Unido, para el desarrollo de otro agente inmunizante contra el covid-19. El mismo está siendo testeado en 1.110 voluntarios desde el final del mes de abril.
Desde el 16 de marzo, un equipo del instituto de investigación de la salud Kaiser Permanente, en Seattle, Estados Unidos, trabaja en forma conjunta con la empresa de biotecnología Moderna en los ensayos clínicos de fase 1 con 45 personas para evaluar una candidata a vacuna que también se basa en el ARNm del Sars-CoV-2. Otro inmunizante potencial, concebido por la empresa china Sinovac Biotech, se encuentra en la fase 1 de los test. Esa vacuna, que se basa en una versión química desactivada del Sars-CoV-2, fue la primera en lograr inmunidad en animales y ahora se la está evaluando en 144 voluntarios de la provincia de Jiangsu, en China.
La sexta fórmula que se está probando en humanos es la que desarrolló la compañía estadounidense Inovio Pharmaceuticals. La vacuna comenzó a aplicarse en humanos siguiendo los ensayos de la fase 1 hacia el comienzo de abril y utiliza una estrategia similar a la del ARNm del Sars-CoV-2.
En Brasil, la búsqueda de una vacuna aún se encuentra en fase de estudios preclínicos, en modelos animales. Científicos de la Fundación Oswaldo Cruz (Fiocruz) de Minas Gerais intentan modificar al virus influenza A (H1N1), causante de la gripe, para poder adosarle tramos del material genético del Sars-CoV-2 y que induzca una respuesta inmunológica en el organismo. En tanto, el grupo del Laboratorio de Inmunología del Instituto del Corazón de la FM-USP se decantó por un abordaje diferente para intentar activar las células de defensa contra el nuevo coronavirus. Los investigadores pretenden combinar VLPs −siglas en inglés que significan partículas con características similares a las de un virus, normalmente reconocidas como un agente invasor por el organismo– y antígenos producidos por el nuevo coronavirus para dilucidar si esa estrategia se muestra capaz de producir anticuerpos contra el SARS-CoV-2.
Republicar