É difícil lembrar de outra situação em que a modelagem matemática de doenças infecciosas tenha usufruído de tanta visibilidade e sido tão prestigiada. “A valorização se deve provavelmente ao estado de perplexidade gerado pela epidemia, porque ninguém esperava um quadro tão sério”, comenta o médico epidemiologista Eduardo Massad, que assumiu o cargo de professor de matemática aplicada na Fundação Getulio Vargas (FGV) no ano passado, depois de se aposentar na Faculdade de Medicina da Universidade de São Paulo (FM-USP).
“Nunca antes a modelagem foi tão necessária quanto agora, diante de uma epidemia que avança tão rapidamente”, reitera o sanitarista e epidemiologista Hélio Neves, da Faculdade de Ciências Médicas da Santa Casa de São Paulo (FCM-SC-SP) e coordenador do Comitê Técnico-Científico Covid-19 da Secretaria Municipal da Saúde de São Paulo.
Embora ainda ofereçam incertezas, na medida em que descrevem situações que mudam com rapidez e das quais têm apenas dados incompletos, as previsões do número de casos ou de mortes expressam o conhecimento acumulado durante pelo menos 250 anos.
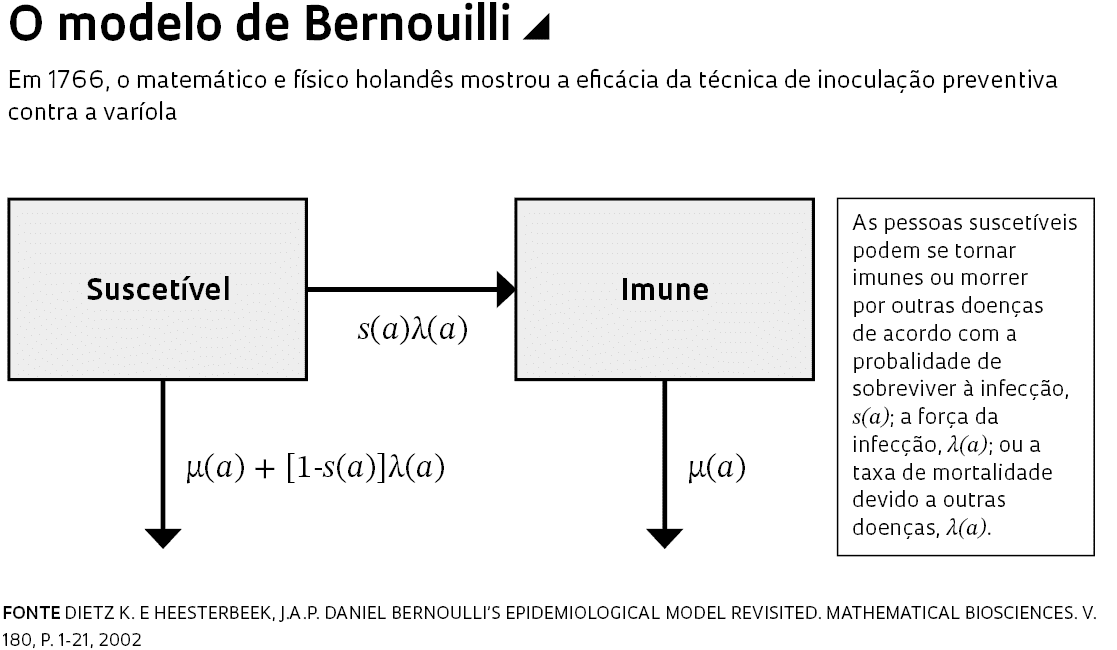
O matemático e físico holandês Daniel Bernoulli (1700-1782), a quem se atribui a primeira modelagem matemática da propagação de doenças infecciosas, elaborou uma abordagem que mostrou a eficácia da técnica de inoculação preventiva contra a varíola, então um problema comum na Europa. Bernoulli apresentou suas ideias em 1760 em dois artigos, um na revista Mémoires de mathématique et de physique e outro na Mercure de France, valendo-se de parâmetros ainda hoje utilizados para examinar os rumos de epidemias.
Bernoulli dividiu a população em dois grupos: os suscetíveis, ainda não infectados; e os imunes, que já tinham adquirido proteção contra uma doença depois de a terem contraído. Suas equações consideraram três variáveis, que faziam as pessoas se moverem do primeiro para o segundo grupo. A primeira era a taxa de reprodução da doença ou força média da infecção, que reflete a transmissão das pessoas infectadas para as suscetíveis. A taxa de mortalidade decorrente da doença era a segunda. A última era a expectativa de vida no momento da infecção. Os cálculos assumiram que a taxa de imunização seria 100% – a inoculação era feita com uma agulha bifurcada – e não haveria risco de transmissão do vírus dos inoculados para os suscetíveis. A inoculação, ele concluiu, poderia ampliar a expectativa de vida de 26 anos e 7 meses para 29 anos e 9 meses.
Snow, John. On the Mode of Communication of Cholera, 2nd Ed, John Churchill, New Burlington Street, London, England, 1855/WIKIMEDIA
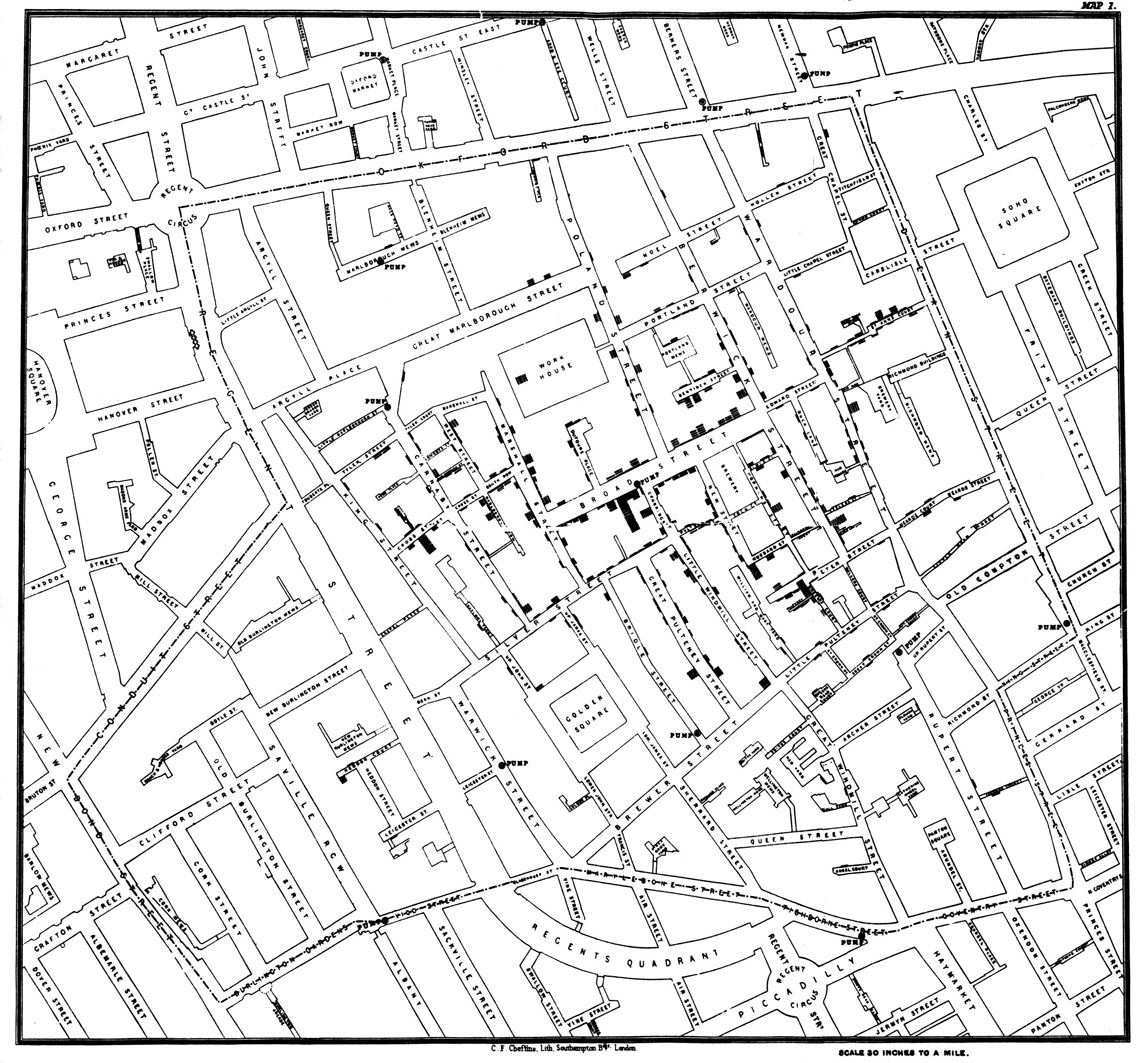
Mapa original de John Snow do bairro de Soho, em Londres, em 1854. Os quadrados e retângulos representam as casas das pessoas que tiveram cóleraSnow, John. On the Mode of Communication of Cholera, 2nd Ed, John Churchill, New Burlington Street, London, England, 1855/WIKIMEDIACólera em Londres
O surto de cólera de Londres em 1854, que no início de setembro daquele ano matou 127 pessoas em apenas três dias, mostrou a importância do trabalho de campo, complementar aos modelos matemáticos. Mesmo sem formação específica em epidemiologia, o anestesiologista inglês John Snow (1813-1858) concluiu que a doença era causada por água contaminada de uma bomba de uso público na Broad Street, hoje Broadwick Street, e não pelo ar fétido da cidade, como pensavam seus colegas e autoridades do governo, adeptos da chamada teoria do miasma.
Snow fez um mapa mostrando que as casas dos que haviam morrido estavam próximas à bomba de água contaminada. O mapa convenceu o reverendo Henry Whitehead (1825-1896) da veracidade da teoria da transmissão da cólera pela água e o estimulou a buscar o primeiro caso para refazerem o percurso do surto, com base em seu conhecimento dos moradores do bairro de Soho, onde o surto havia começado e se expandia. “Foi Whitehead quem forneceu [a Snow] a evidência crucial para determinar o verdadeiro papel que a bomba desempenhou” no surto de cólera, relatou o linguista norte-americano Steven Johnson no livro O mapa fantasma (Zahar, 2008).

Justinc/WIKIMEDIA
Bomba pública de água de Londres responsável pelo surto de cólera de 1854Justinc/WIKIMEDIASnow morreu de infarto aos 45 anos sem ser reconhecido por suas ideias. Whitehead acompanhou outro surto de cólera em Londres, em 1866, desta vez com o epidemiologista britânico William Farr (1807-1883), um dos fundadores da estatística médica. Por conhecer as ideias de Snow e estar em um comitê de saúde do governo, Farr examinou a água fornecida por duas empresas aos moradores da cidade. Descobriu que uma delas fornecia água contaminada e imediatamente ordenou que se afixassem cartazes alertando os moradores para não consumirem qualquer água que não tivesse sido previamente fervida.
O bioquímico William Ogilvy Kermack (1898-1970) e o epidemiologista Anderson Gray McKendrick (1876-1943), ambos escoceses, do Royal College of Physicians, de Edimburgo, elaboraram uma teoria sobre a transmissão de doenças infecciosas, apresentada em artigo de 1927 na revista Proceedings of the Royal Society A, que se tornou a base para as modelagens atuais. Foi o modelo SIR, correspondendo às iniciais de três grupos, os suscetíveis, os infectados e os recuperados, que aprofundou os conceitos de Bernoulli. Durante uma epidemia, as pessoas mudam de um grupo para outro à medida que uma pessoa infectada transmite o agente causador de uma doença para uma comunidade de indivíduos mais ou menos suscetíveis. A epidemia avança, de acordo com taxas de transmissão e letalidade que variam desde o início até o fim, e termina quando os suscetíveis, depois de terem sido infectados, tornam-se imunes e se recuperam ou morrem.
O modelo SIR ganhou refinamentos. O R passou a significar removidos, incluindo, além dos recuperados, os mortos, principalmente a partir da década de 1970, quando a modelagem matemática começou a ser feita por computadores.
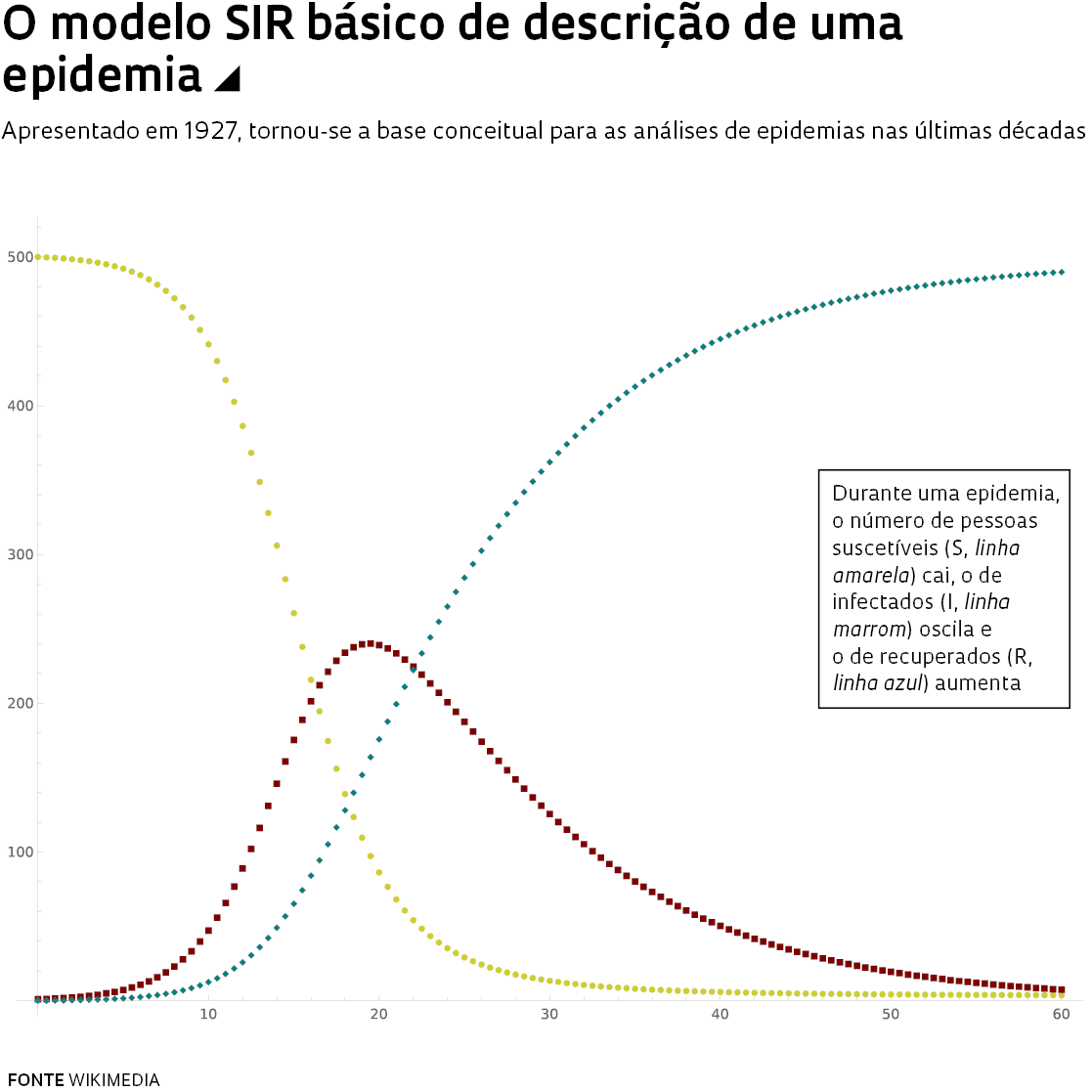
Modelo SIR básico de descrição de uma epidemia: o número de pessoas suscetíveis (S, linha amarela) cai, o de infectados (I, linha marrom) oscila e o de recuperados (R, linha azul) aumenta
Economia de US$ 15 milhões
Com base nesses conceitos, a partir dos anos 1980 Massad examinou os mecanismos de transmissão de malária, sarampo, dengue, febre amarela e, mais recentemente, síndrome respiratória aguda grave (Sars), zika, entre outras doenças infecciosas, quando possível propondo novas estratégias de prevenção. Em 1992, com base em seus cálculos, a Secretaria do Estado da Saúde de São Paulo (SES-SP) economizou cerca de US$ 15 milhões ao vacinar apenas as crianças entre 1 e 10 anos, em vez de seguir a recomendação da Organização Pan-americana da Saúde (Opas) e imunizar toda a população entre 9 meses e 15 anos, com a vacina tríplice, contra sarampo, caxumba e rubéola (ver Pesquisa FAPESP nº 8). Detalhada em um artigo publicado em 1993 na revista Epidemiology & Infection, a estratégia paulista se provou acertada.
“Usamos o modelo Seir, com muitos mais compartimentos”, explica o físico Roberto Kraenkel, professor do Instituto de Física Teórica da Universidade Estadual Paulista (IFT-Unesp). Com colegas da USP e da Universidade Federal do ABC (UFABC), ele coordena o Observatório Covid-19 BR, plataforma on-line lançada em 15 de março com análises sobre a evolução do número de casos da doença no Brasil. “Dividimos a população em suscetíveis, expostos, mas não infecciosos, e infecciosos, por sua vez divididos em graus leves e graves e hospitalizados ou não. Por fim, há os removidos, porque estão imunes ou porque morreram”, conta.
A equipe do Observatório reúne atualmente 40 pesquisadores do Brasil, dos Estados Unidos e da Alemanha. “Eles são super-rápidos”, observa Neves, da Santa Casa e da Secretaria Municipal da Saúde, que fornece os dados sobre os casos registrados na capital paulista. “Apresento um problema, eles fazem os cálculos e as estimativas e em três horas dão uma resposta.”
Segundo ele, as previsões sobre o número de casos e de mortes estão sendo úteis para planejar a ampliação da rede de laboratórios de testes diagnósticos e de leitos em hospitais, o uso de escolas e centros esportivos para receber pessoas com a forma mais leve da Covid-19 e o trabalho nos cemitérios públicos. “A taxa de ocupação dos hospitais municipais não tem passado de 60%, porque estamos ampliando o número de leitos continuamente”, diz Neves. “O maior problema é que não sabemos quando será o pico da epidemia.”
Um dos grupos do Observatório determinou as cidades com maior risco de disseminar e de receber o vírus de São Paulo, Rio de Janeiro, Minas Gerais, dos três estados da região Sul e nos nove da Nordeste, com base no fluxo rodoviário. Os estudos foram publicados em abril como preprint na base de artigos científicos Scielo.
“Tão importante quanto o tamanho dos municípios para o espalhamento do vírus é o número de conexões ou de linhas rodoviárias de ônibus com outras cidades”, explica o ecólogo Paulo Guimarães, pesquisador do Instituto de Biociências da USP e coordenador da análise sobre o estado de São Paulo. Por essa razão, segundo ele, Campinas e São José do Rio Preto têm uma vulnerabilidade alta, proporcionalmente maior que a população, por causa das conexões, a primeira com 214 cidades e a segunda com 135. Antes, com base no fluxo aéreo de pessoas entre as capitais, esse grupo e outro, da Fundação Oswaldo Cruz (Fiocruz), tinham examinado as possíveis rotas da epidemia no país.
“O diálogo entre os especialistas de áreas diferentes tem sido muito produtivo”, reitera a epidemiologista Maria Amélia Veras, da FCM-SC-SP, que colabora com o Observatório examinando os dados enviados e as conclusões. “As modelagens tentam se aproximar da realidade com parâmetros previamente conhecidos, por causa de doenças semelhantes”, ressalta. De fato, um grupo de epidemiologistas da Fiocruz se apoiou em um banco de dados sobre gripe no Brasil, o Infogripe, para prever os rumos da Covid-19 no Brasil. Outro, da Universidade de Brasília, adaptou um modelo matemático usado na epidemia de sarampo para estudar o alcance da doença na Grande São Paulo.
“O principal limite dos modelos é a qualidade da informação que os alimenta, porque estamos examinando fenômenos que mudam rapidamente”, pondera Veras. Ainda que se tenham evidências de que a Covid-19 seja mais grave em pessoas com mais de 60 anos, não se sabe a taxa de transmissão entre grupos de idades diferentes nem o número real de pessoas infectadas, já que apenas as hospitalizadas são testadas.
Outro problema que contribui para a incerteza dos resultados é que a taxa inicial de transmissão do vírus entre as pessoas, a chamada R0, transforma-se em taxa efetiva, Re, ao longo da epidemia. Valores acima de 1 indicam que o número de casos está aumentando, próximos a 1 indicam estabilidade, abaixo, uma redução de casos novos.
No final de abril na cidade de São Paulo, o Re oscilava ao redor de 1, o que significa que uma pessoa transmitia o vírus para outra, em média. “Estamos em uma fase de número estável de casos, mas ainda é um número alto, da ordem de 100 a 200 novos casos graves por dia no município”, diz o ecólogo da USP Paulo Inácio Prado, um dos coordenadores do Observatório Covid-19. “Não é uma situação confortável, embora seja melhor do que o crescimento exponencial da primeira quinzena de março, quando o Re estava entre 2 e 3.”
Ainda não se conhece a real dimensão da epidemia no país por causa do acúmulo de testes diagnósticos ainda a serem feitos. “O represamento dos exames gera uma subnotificação e faz com que, nos modelos, a epidemia pareça mais lenta do que é na realidade”, diz Kraenkel.
“Corrigimos os modelos à medida que os dados chegam, mas sempre temos um risco enorme de errar”, diz Massad. Segundo ele, só será possível conhecer o provável alcance da pandemia depois de pelo menos um ano que ela tiver terminado, por meio da chamada soroprevalência, que indica, por meio de exames de sangue, a proporção de pessoas com anticorpos contra o vírus em relação ao número de casos registrados de pessoas infectadas.
Artigos científicos
BERNOULLI, D. Essai d’une nouvelle analyse de la mortalite causee par la petite verole et des avantages de l’inoculation pour la prevenir. Mémoires de mathématique et de physique, presentés à l’Académie Royale des Sciences. n. 1, 1760.
BERNOULLI, D. Reflexions sur les avantages de l’inoculation. Mercure de France, n. 173, 1760.
KERMACK, W. O e MCKENDRICK, A. G. A contribution to the mathematical theory of epidemics. Proceedings of the Royal Society A – Mathematical Physical and Engineering Sciences. v. 115, n. 772, p. 700-21. 1º ago. 1927.
MASSAD, E. et al. A model-based design of a vaccination strategy against rubella in a non-immunized community of Sao Paulo State, Brazil. Epidemiology & Infection. v. 112, n. 3, p. 579-94, 1993.
MUNIZ, D. G. et al. Vulnerabilidade das microrregiões do estado de São Paulo à pandemia do novo coronavírus (Sars-CoV-2). Pré-print Scielo. 15 abr. 2020.
MAIA, K. P. et al. Vulnerability of micro-regions within Northeast Brazil to the new coronavirus (Sars-CoV-2) pandemic. Pré-print Scielo. 17 abr. 2020.
EMER, C. et al. Vulnerabilidade das microrregiões da região Sul do Brasil à pandemia do novo coronavírus (Sars-CoV-2). Pré-print Scielo. 23 abr. 2020
ROCHA FILHO, T. M. et al. Expected impact of Covid-19 outbreak in a major metropolitan area in Brazil. medRxiv. Pré-print. 14 mar. 2020.
Livro
JOHNSON, S. O mapa fantasma – Como a luta de dois homens contra o cólera mudou o destino de nossas metrópoles. Rio de Janeiro: Zahar, 2008.