Em uma das mais conhecidas cirurgias de revascularização cardíaca, um segmento de uma veia da perna – a safena – é implantado no coração para restabelecer o fluxo de sangue para partes do órgão privadas de oxigênio e nutrientes em decorrência de um bloqueio arterial causado por coágulo sanguíneo ou placas de gordura. O médico argentino René Favaloro (1923-2000) revolucionou a cirurgia cardíaca ao criar em 1967 essa técnica – a ponte de safena – para ajudar a tratar uma das doenças que mais matam no mundo: a doença arterial coronariana. A transposição de uma veia para as condições de funcionamento de uma artéria, no entanto, nem sempre é uma solução duradoura nem se dá sem problemas. Quase metade dos implantes sofre obstrução e precisa ser substituída até uma década após a revascularização.
Em um artigo publicado em 29 de junho na revista Scientific Reports, a equipe do médico José Eduardo Krieger, do Instituto do Coração (InCor) da Universidade de São Paulo (USP), começou a identificar as transformações iniciais que ocorrem em veias submetidas ao papel de artéria e podem levar ao comprometimento do enxerto. Veias transportam sangue em regime de baixa pressão, enquanto artérias o conduzem sob pressão elevada. Por essa razão, assim que o médico libera a circulação no implante de veia safena suturada à artéria coronária, a mudança de ambiente é drástica.
Mantida por certo tempo sob pulsos de pressão maiores do que aqueles a que está habituada, a veia começa a apresentar modificações físicas e bioquímicas em suas células. Na camada mais interna, o endotélio, as células parecem desorganizar momentaneamente o citoesqueleto, que lhes dá forma e sustentação. Ao mesmo tempo, aumenta a concentração de compostos que danificam as estruturas celulares e diminui a de outros que as protegem. Essas mudanças podem deixar a superfície interna do vaso inflamada, mais aderente e fazer suas camadas mais externas se espessarem, contribuindo para a oclusão. “Nossos dados sugerem que a intensidade desse processo patológico é variável e pode levar a problemas no enxerto”, conta Krieger, coordenador de uma equipe que investiga como essa alteração de regime de funcionamento afeta as diferentes camadas das veias.
Os resultados apresentados agora complementam os obtidos anos atrás. Nos primeiros trabalhos, feitos com ratos que passaram por uma cirurgia para conectar uma veia a uma artéria do pescoço (simulando as condições da safena na ponte cardíaca), o grupo do InCor havia observado uma reprogramação gênica que, em até duas semanas, conduzia a uma proliferação celular intensa nas camadas mais internas da veia. Em geral formado por uma única camada de células, esse revestimento do vaso – chamado de endotélio, ou camada íntima – tornava-se até 100 vezes mais espesso, enquanto a camada média, imediatamente externa a ele e composta por células musculares contráteis, dobrava de espessura (ver Pesquisa FAPESP nº 160). Esse aumento de robustez, considerado uma provável adaptação à alta pressão, é controlado pelo gene CRP3, que mais tarde os pesquisadores verificaram ser responsável por modular a morte celular programada (apoptose). A diminuição da atividade desse gene reduz a morte celular e favorece o espessamento exacerbado do vaso.
Agora, trabalhando com células cultivadas in vitro, o grupo regrediu mais no tempo e registrou transformações que ocorrem nas primeiras horas sob o novo regime de funcionamento. No doutorado, feito sob a orientação da biomédica Ayumi Miyakawa, a também biomédica Thais Girão da Silva cultivou por quatro dias células do endotélio extraídas de safena humana sobre uma placa flexível de silicone. Uma bomba de vácuo controlava a deformação da superfície da placa, permitindo reproduzir nas células do endotélio os movimentos de estiramento cíclicos a que estão sujeitas as células da parede de uma artéria.
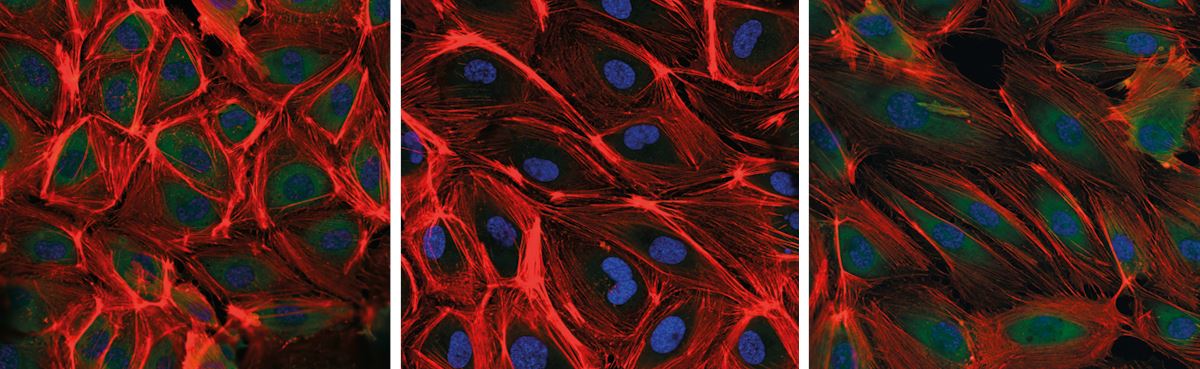
Já nas primeiras 24 horas surgiram mudanças. Normalmente com aparência de um paralelepípedo, as células do endotélio se tornaram mais alongadas. Outra transformação ocorreu no citoesqueleto, que ficou bem mais espesso. “As células pareciam estar se reestruturando para suportar o nível alto de estiramento, em um fenômeno que, na veia, é conhecido como arterialização”, conta Girão.
Um dia mais tarde, outra alteração surpreendeu os pesquisadores. Uma das partes estruturais do citoesqueleto, formada por fibras de actina, praticamente desapareceu. Embora exista a possibilidade de que modificações em sua estrutura tridimensional as tenham tornado invisíveis aos compostos usados para marcá-las, outros testes sugerem que tenham sido desmontadas em unidades menores e depois transportadas para o núcleo da célula, onde podem alterar o funcionamento de alguns genes.
O provável desmonte do citoesqueleto foi acompanhado de mudanças bioquímicas. Houve uma redução importante na síntese de óxido nítrico (NO), gás produzido pelas células endoteliais com funções variadas e benéficas para o vaso – ele impede a adesão de células à parede interna do vaso e favorece a proliferação celular no endotélio, mas bloqueia essa multiplicação na camada muscular da veia. Níveis baixos de NO deixam o interior do vaso mais aderente a células inflamatórias ao mesmo tempo que favorecem o espessamento da camada muscular da safena. Em paralelo, os pesquisadores verificaram um aumento da produção de espécies reativas de oxigênio (radicais livres), moléculas potencialmente lesivas para diversas estruturas das células.
Thais Girão da Silva / InCor
Células do endotélio de safena submetidas à condição de veia (à esq.) e depois de 24 horas (centro) e 48 horas (à dir.) sob regime de estiramento de artériaThais Girão da Silva / InCorO grupo do InCor notou ainda a reconfiguração de complexos de proteínas localizados na superfície das células nos quais ficam ancoradas as fibras do citoesqueleto. Chamados de adesões focais, esses complexos proteicos funcionam como sensores: detectam as condições do meio extracelular, como a intensidade da força que causa o estiramento, e transferem a informação para o interior da célula, desencadeando sinais químicos que governam o seu funcionamento. Após 48 horas de níveis elevados de estiramento, as adesões focais das células de safena encolheram ao mesmo tempo que perderam a aparência fusiforme e se tornaram esféricas. “Esse conjunto de transformações parece ser uma tentativa da célula de reajustar sua sensibilidade às novas condições do meio”, explica Krieger. As alterações bioquímicas e estruturais não ocorrem em células do endotélio de artéria submetido às mesmas condições.
“Estudos de fisiologia celular como esse nos ajudam a compreender quais mecanismos podem estar por trás da falha dos enxertos venosos e podem levar ao desenvolvimento de tratamentos”, comenta o cardiologista Francisco Laurindo, do InCor, que não participou da pesquisa. “Esses resultados dão a plausibilidade biológica necessária para explicar os fenômenos que ocorrem com os enxertos de safena e observamos na prática clínica”, complementa o cardiologista Andrei Sposito, da Universidade Estadual de Campinas (Unicamp).
A equipe de Krieger ainda busca entender a ordem em que os fenômenos ocorrem. Com base nos resultados desse e de outros trabalhos, o grupo suspeita que o aumento de espécies reativas de oxigênio leve ao desmonte das fibras de actina e reduza a disponibilidade de óxido nítrico, desencadeando outras mudanças responsáveis pela degeneração da ponte de safena. Quando trataram as células com um composto antioxidante antes de iniciar o experimento, houve redução do desmonte do citoesqueleto e das proteínas inflamatórias. “Entender esse processo talvez torne possível propor formas de intervenção durante o preparo da safena que possam melhorar o seu desempenho”, propõe Miyakawa.
Projeto
Genômica cardiovascular: Mecanismos & novas terapias – CVGen mech2ther (nº 13/17368-0); Modalidade Projeto Temático; Pesquisador responsável José Eduardo Krieger (USP); Investimento R$ 8.466.618,88.
Artigo científico
GIRÃO-SILVA, T. et al. High stretch induces endothelial dysfunction accompanied by oxidative stress and actin remodeling in human saphenous vein endothelial cells. Scientific Reports. 29 jun. 2021.
