En una de las cirugías de revascularización cardíaca más conocidas, se procede a realizar un injerto de un segmento de una vena de la pierna –la safena– en el corazón, para restablecer el flujo sanguíneo hacia las partes de este órgano privadas de oxígeno y de nutrientes como consecuencia de un bloqueo arterial causado por un coágulo o por placas de grasa. El médico argentino René Favaloro (1923-2000) revolucionó la cirugía cardíaca en 1967, cuando creó esta técnica –el puente de safena o baipás coronario– para ayudar a tratar una de las enfermedades más mortíferas del mundo: la enfermedad arterial coronaria. Sin embargo, la transposición de una vena a las condiciones de funcionamiento de una arteria no siempre constituye una solución duradera ni transcurre sin generar problemas. Casi la mitad de los implantes se obstruyen y deben ser sustituidos hasta una década después de la revascularización.
En un artículo publicado el 29 de junio en la revista Scientific Reports, el equipo de trabajo del médico José Eduardo Krieger, del Instituto del Corazón (InCor) de la Universidad de São Paulo (USP), en Brasil, comenzó a identificar las transformaciones iniciales que se producen en las venas sometidas a cumplir el papel de arterias y pueden llevar al deterioro del injerto. Las venas transportan la sangre en un régimen de baja presión, mientras que las arterias la conducen a alta presión. Por esta razón, tan pronto como el médico habilita la circulación en el implante de vena safena suturada hacia la arteria coronaria, el cambio de ambiente es drástico.
La vena, sometida durante cierto tiempo a pulsos de presión mayores que los que está habituada a recibir, comienza a sufrir alteraciones físicas y bioquímicas en sus células. En su capa interna, el endotelio, las células parecen desorganizar momentáneamente el citoesqueleto, que les da forma y soporte. Al mismo tiempo, aumenta la concentración de compuestos que dañan las estructuras celulares y disminuye la de otros que las protegen. Estos cambios pueden provocar la inflamación de la superficie interna del vaso, dejándola más adherente, y un engrosamiento de sus capas externas, que contribuyen a que se produzcan oclusiones. “Nuestros datos sugieren que la intensidad de este proceso patológico es variable y puede generar problemas en el injerto”, dice Krieger, coordinador de un equipo que estudia de qué manera esta alteración del régimen de funcionamiento afecta a las diferentes capas de las venas.
Los resultados que se han informado ahora complementan los obtenidos años atrás. En los primeros trabajos, que se realizaron con ratas sometidas a una cirugía para conectar una vena a una arteria del cuello (simulando las condiciones de la safena en el baipás cardíaco), el grupo del InCor había notado una reprogramación génica, que en un lapso de hasta dos semanas generaba una proliferación celular masiva en las capas internas de la vena. Este revestimiento del vaso sanguíneo –denominado endotelio, o capa íntima– generalmente formado por una única capa de células, se engrosaba hasta 100 veces, mientras que la capa media, exteriormente contigua y compuesta por células musculares contráctiles, duplicaba su espesor (lea en Pesquisa FAPESP, edición nº 160). Este aumento de su robustez, considerado como una probable adaptación a una presión más elevada, está controlado por el gen CRP3, que los investigadores descubrieron posteriormente que es el responsable de modular la muerte celular programada (apoptosis). La disminución de la actividad de este gen reduce la muerte celular y propicia el engrosamiento exacerbado del vaso sanguíneo.
Ahora, en un estudio con células cultivadas in vitro, el grupo pudo retroceder más en el tiempo y registrar las transformaciones que ocurren durante las primeras horas bajo el nuevo régimen de funcionamiento. En su doctorado, realizado bajo la dirección de la biomédica Ayumi Miyakawa, la también biomédica Thais Girão da Silva cultivó células del endotelio extraídas de la vena safena humana sobre una placa flexible de silicona durante cuatro días. Una bomba de vacío controlaba la deformación de la superficie de la placa, lo que permitía reproducir en las células del endotelio los movimientos de estiramiento cíclicos a los que se encuentran sometidas las células de la pared arterial.
Ya durante las primeras 24 horas se produjeron cambios. Las células del endotelio, que normalmente presentan el aspecto de un paralelepípedo, se estiraron. Hubo otra transformación en el citoesqueleto, que aumentó su grosor. “En apariencia, las células se estaban reestructurando para soportar el alto nivel de estiramiento, en un fenómeno que, en la vena, se conoce como arterialización”, relata Girão.
Al día siguiente apareció otra alteración que sorprendió a los científicos. Una de las partes estructurales del citoesqueleto, formada por fibras de actina, prácticamente desapareció. Aunque cabe la posibilidad de que las modificaciones en su estructura tridimensional las hayan vuelto invisibles a los compuestos empleados para marcarlas, otras pruebas sugieren que se habrían disgregado en unidades más pequeñas y tras ello, fueron transportadas hacia el núcleo de las células, donde pueden alterar el funcionamiento de algunos genes.
El probable desmantelamiento del citoesqueleto ocurrió a la par de ciertos cambios bioquímicos. Hubo una reducción importante en la síntesis de óxido nítrico (NO), un gas producido por las células endoteliales que cumple funciones múltiples y beneficiosas para el vaso sanguíneo: impide que se adhieran células sobre la pared interna del vaso y estimula la proliferación celular en el endotelio, pero bloquea dicha multiplicación en la capa muscular de la vena. Los bajos niveles de NO dejan el interior del vaso sanguíneo más adherente a las células inflamatorias y simultáneamente propician el engrosamiento de la capa muscular de la vena safena. Simultáneamente, los investigadores constataron un aumento en la producción de formas reactivas de oxígeno (radicales libres), moléculas potencialmente dañinas para diversas estructuras de las células.
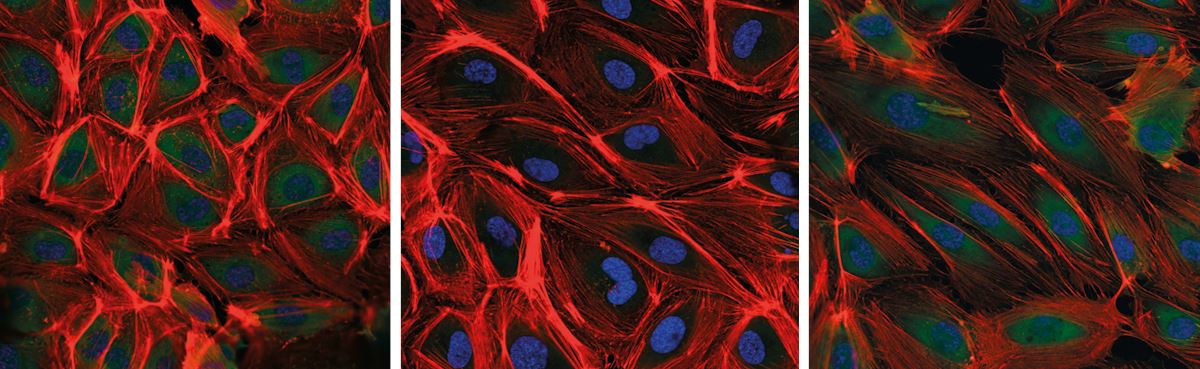
Thais Girão da Silva / INCOR
Células del endotelio de la vena safena sometidas a la condición de vena (a la izq.) y luego de 24 horas (centro) y 48 horas (a la der.) bajo un régimen de estiramiento como arteriaThais Girão da Silva / INCOREl grupo del InCor también notó un reordenamiento de los complejos proteicos situados en la superficie de las células que constituyen el anclaje de las fibras del citoesqueleto. Estos complejos proteicos, llamados adherencias focales, funcionan como sensores: detectan las condiciones del medio extracelular, como la intensidad de la fuerza que causa el estiramiento, y transfieren esta información hacia el interior de las células, desencadenando las señales químicas que rigen su funcionamiento. Tras soportar 48 horas de niveles elevados de estiramiento, las adherencias focales de las células de la vena safena se redujeron, al tiempo que perdieron su apariencia fusiforme y se volvieron esféricas. “Este conjunto de transformaciones parece ser un intento de las células para recalibrar su sensibilidad a las nuevas condiciones del medio”, explica Krieger. Las alteraciones bioquímicas y estructurales no ocurren en las células del endotelio de la arteria sometidas a las mismas condiciones.
“Estudios de fisiología celular como este nos ayudan a entender cuáles son los mecanismos que estarían detrás del fracaso de los injertos venosos y podrían llevar al desarrollo de tratamientos”, comenta el cardiólogo Francisco Laurindo, del InCor, quien no participó en la investigación. “Estos resultados aportan la plausibilidad biológica necesaria como para explicar los fenómenos que ocurren con los injertos de safena y que observamos en la práctica clínica”, añade el cardiólogo Andrei Sposito, de la Universidad de Campinas (Unicamp).
El equipo de Krieger sigue intentando entender el orden en que se suscitan los fenómenos. Con base en los resultados de este y otros estudios, el grupo sospecha que el incremento de las especies reactivas de oxígeno sería lo que provoca la desarticulación de las fibras de actina y la reducción de la disponibilidad de óxido nítrico, desencadenando otras alteraciones responsables del deterioro del puente de safena. Cuando trataron a las células con un compuesto antioxidante antes de iniciar el experimento, se registró una disminución del desmantelamiento del citoesqueleto y de las proteínas inflamatorias. “La comprensión de este proceso quizá haga posible proponer métodos de intervención durante la preparación de la vena safena que puedan mejorar su desempeño”, propone Miyakawa.
Proyecto
Genómica cardiovascular: Mecanismos y nuevas terapias – CVGen mech2ther (nº 13/17368-0); Modalidad Proyecto Temático; Investigador responsable José Eduardo Krieger (USP); Inversión R$ 8.466.618,88
Artículo científico
GIRÃO-SILVA, T. et al. High stretch induces endothelial dysfunction accompanied by oxidative stress and actin remodeling in human saphenous vein endothelial cells. Scientific Reports. 29 jun. 2021.