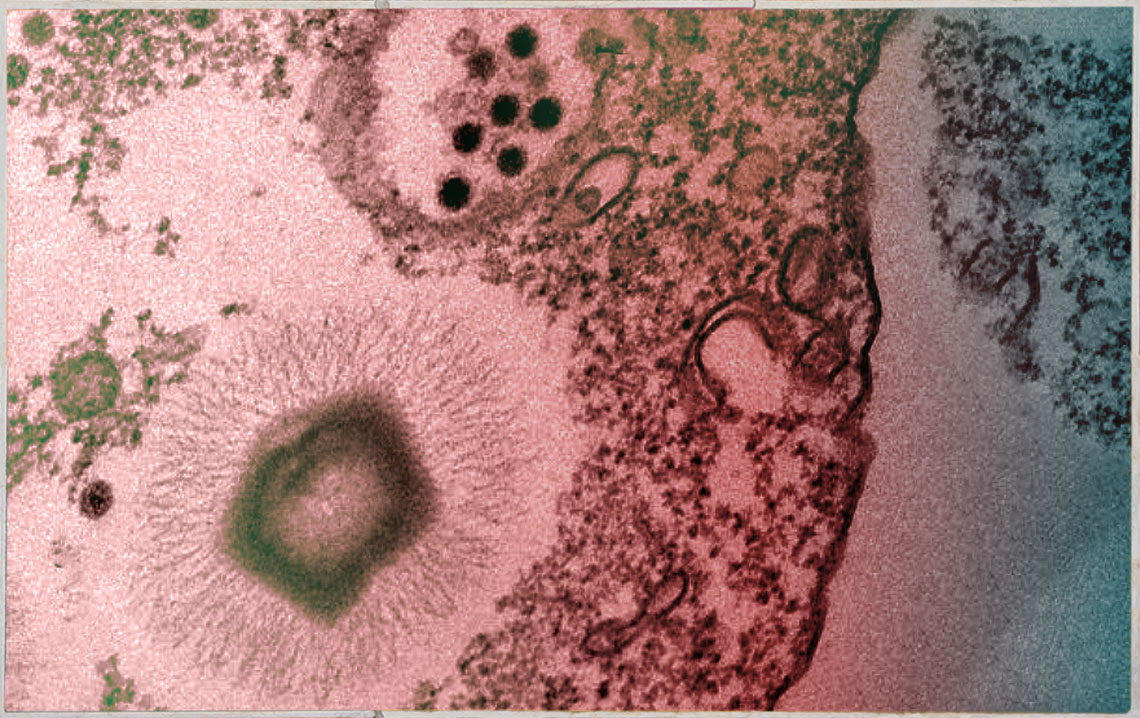
No final de 2019, a bióloga Bruna Azevedo recebeu uma imagem instigante do Centro de Microscopia da Universidade Federal de Minas Gerais (UFMG). Dentro de uma ameba, além de vírus gigantes, dezenas de vezes maiores que os que causam a gripe ou a Covid-19, havia pontos pretos e densos que pareciam partículas virais. Seu orientador, o virologista Jônatas Abrahão, que estuda vírus gigantes desde 2011, coletou material e mandou para colegas da Universidade Estadual Paulista (Unesp), pedindo que fizessem uma análise genômica.
Os resultados chegaram duas semanas depois e delinearam, pela primeira vez no Brasil, relações de parasitismo entre vírus, detalhadas em um artigo publicado em janeiro de 2022 na revista científica Viruses. Mais ainda: ajudaram a rever conceitos sobre o papel dos vírus e atestaram uma incessante troca de genes no interior de protozoários como a ameba, que assim se tornam espaços de formação de novas espécies de organismos, embora persista o debate sobre se os vírus seriam ou não seres vivos.
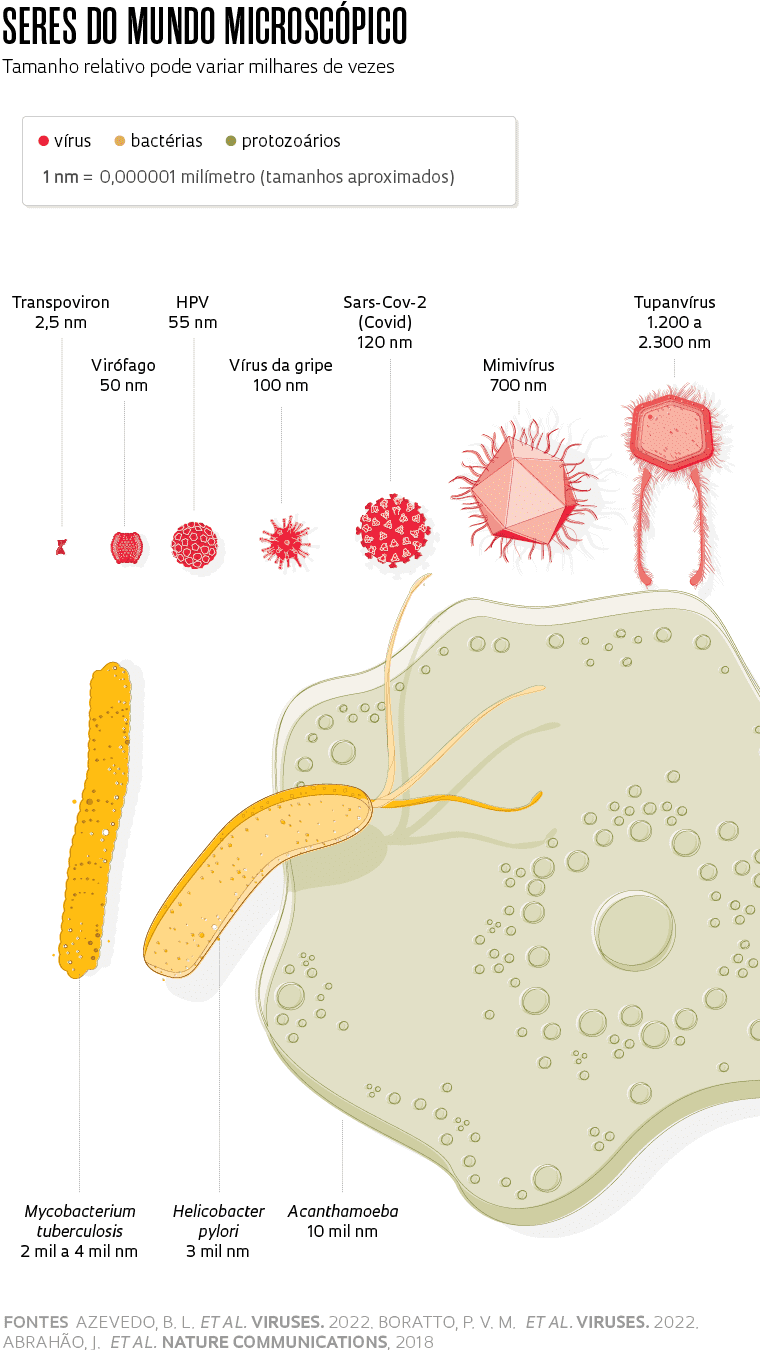
Examinadas primeiramente no microscópio óptico, pelo menos 20 Acanthamoeba castellanii, com tamanhos entre 10 e 60 micra (1 mícron equivale à milésima parte do milímetro), coletadas na lagoa da Pampulha, a menos de 1 quilômetro do laboratório de Abrahão, abrigavam dezenas de uma variedade nova de Mimivírus, vírus gigante da família Mimiviridae. Com diâmetro de cerca de 0,7 mícron, tem um genoma com cerca de 1,2 milhão de pares de bases, formado por uma fita dupla de DNA, protegido por um icosaedro proteico, chamado capsídeo.
Os pontos pretos que haviam intrigado Azevedo e Abrahão eram virófagos, vírus bem menores, também de fita dupla de DNA e capsídeo, apresentados por pesquisadores franceses da Universidade de Marselha como parasitas únicos de Mimivírus em setembro de 2008 na revista científica Nature. Os virófagos encontrados no interior das amebas da lagoa de Belo Horizonte tinham cerca de 50 nm de diâmetro e um genoma de 18.880 pares de bases, quase 70 vezes menor que os Mimivírus.
Outra surpresa: havia também outro tipo de parasita, o chamado Transpoviron. Definido como elemento genético derivado de vírus, é constituído por um trecho de DNA com menos de 10 genes e cerca de 2,5 nm de diâmetro, sem capsídeo.
Como um elefante na sala
Desconhecida até então no Brasil, essa relação entre Transpovirons, Virófagos e vírus gigantes foi descrita pela primeira vez na revista científica PNAS em outubro de 2012, também por pesquisadores de Marselha, na França. A despeito da diferença de tamanho, os participantes dessa relação tripla de parasitismo são todos vírus, porque dependem de outros organismos ao se multiplicarem. “Um vírus se aproveita das enzimas do outro ao se multiplicar e todos se aproveitam das da ameba”, sintetiza Abrahão.
Os virófagos não se integram ao genoma das amebas, mas podem mergulhar em Cafeteria roenbergensis, um microrganismo marinho em que se abrigam. Os hospedeiros, definidos como protistas flagelados, ganham com isso. “Quando um vírus gigante infecta o flagelado, seu genoma, integrado ao do hospedeiro, é ativado e começa a produzir partículas de virófagos, que atrapalham a multiplicação do vírus gigante no ambiente”, diz Abrahão.
Em geral o hospedeiro sai perdendo: “A multiplicação dos vírus geralmente implica a morte dos organismos ou células em que viviam”, diz a virologista Juliana Reis Cortines, da Universidade Federal do Rio de Janeiro (UFRJ), que trabalha com vírus gigantes desde 2013. “Mesmo que não sejam patogênicos, os vírus gigantes prejudicam os hospedeiros, como um elefante com espinhos dentro da sala.”
Em seu trabalho mais recente, publicado em junho na Frontiers in virology, Cortines verificou que a entrada de um vírus gigante chamado Tupanvírus em células de pulmão e a detecção de seus espinhos – ou fibrilas – disparam a produção de moléculas chamadas citocinas e um processo inflamatório similar ao ativado após a invasão de bactérias. O resultado é a morte celular, como ocorre também com os protozoários.
Em laboratório, as amebas explodem em dois dias após serem ocupadas pelos vírus. É um tempo suficiente, porém, para o vírus pôr a célula hospedeira a seu serviço e gerar milhares de cópias dele mesmo. As relações entre os vírus e deles com seus hospedeiros indicam que o interior de protozoários é como uma floresta, na qual diferentes tipos de organismos disputam sem parar enzimas e nutrientes que assegurem sua sobrevivência, ainda que prejudicando a de outros.
Antes de as células se romperem e liberarem uma nova safra de vírus, os organismos que as ocupam trocam genes entre si, aleatoriamente, em uma frequência ainda desconhecida. “Como as amebas também abrigam fungos e bactérias, há chances inesgotáveis de cruzamento de genomas de diferentes espécies de microrganismos”, diz Cortines, coautora de um artigo publicado em dezembro de 2016 na Microbiological Research, que apresenta esse grupo de protozoários como “hospedeiro universal para microrganismos patogênicos”.
Abrahão acrescenta: “O interior de microrganismos unicelulares é um ambiente que favorece a formação de novas espécies”. Um desses espaços é o corpo humano, na medida em que as amebas – os principais hospedeiros de vírus gigantes – vivem no intestino e na pele. Amebas vivem também em outros animais e na água de rios e lagoas.
Vírus benéficos
Os vírus gigantes foram identificados em 2003 em amostras de água de ar-condicionado coletadas em um hospital da cidade de Bradford, no Reino Unido, e até agora não estão associados a nenhuma doença em seres humanos. Devem ter evoluído com as amebas, os primeiros organismos unicelulares, que surgiram há cerca de 1 bilhão de anos.
“Quanto mais antiga a coexistência, mais amigável tende ser a relação dos vírus com outros organismos”, diz o virologista Fernando Spilki, da Universidade Feevale, no Rio Grande do Sul, especialista em vírus de bovinos e coordenador da Rede Nacional de Ômicas da Covid-19 (Rede Corona-ômica BR). Como exemplo, ele cita o HIV, o Sars-Cov-2 e o vírus da gripe, cuja letalidade diminui ao longo de décadas à medida que se estende a convivência com as pessoas. Por outro lado, há vírus, como o da raiva e da poliomielite, que aparentemente não se tornaram menos mortais.
Ainda que contrarie o senso comum, que associa os vírus a doenças, predominam as relações pacíficas, também chamadas de comensais – quando uma espécie se beneficia da convivência com outra, como os peixes pequenos que se alimentam dos restos de comida deixados pelos tubarões. “A maioria dos vírus não causa doenças”, diz o virologista Murilo Zerbini, da Universidade Federal de Viçosa (UFV), Minas Gerais, especialista em vírus de plantas e presidente do Comitê Internacional de Taxonomia de Vírus (ICTV).
“Eles podem até mesmo beneficiar outros organismos”, diz. Como exemplo, Zerbini cita o vírus da tolerância térmica de Curvularia (CThTV), que permite ao fungo Curvularia protuberata e à gramínea Dichanthelium lanuginosum viverem uma relação mutualística, de benefícios recíprocos, e crescerem sob temperaturas de até 65 graus Celsius (ºC) no noroeste dos Estados Unidos. Sem o vírus, nem o fungo nem o capim resistiriam a mais de 38 ºC, como descrito em um artigo da Science de 2007.
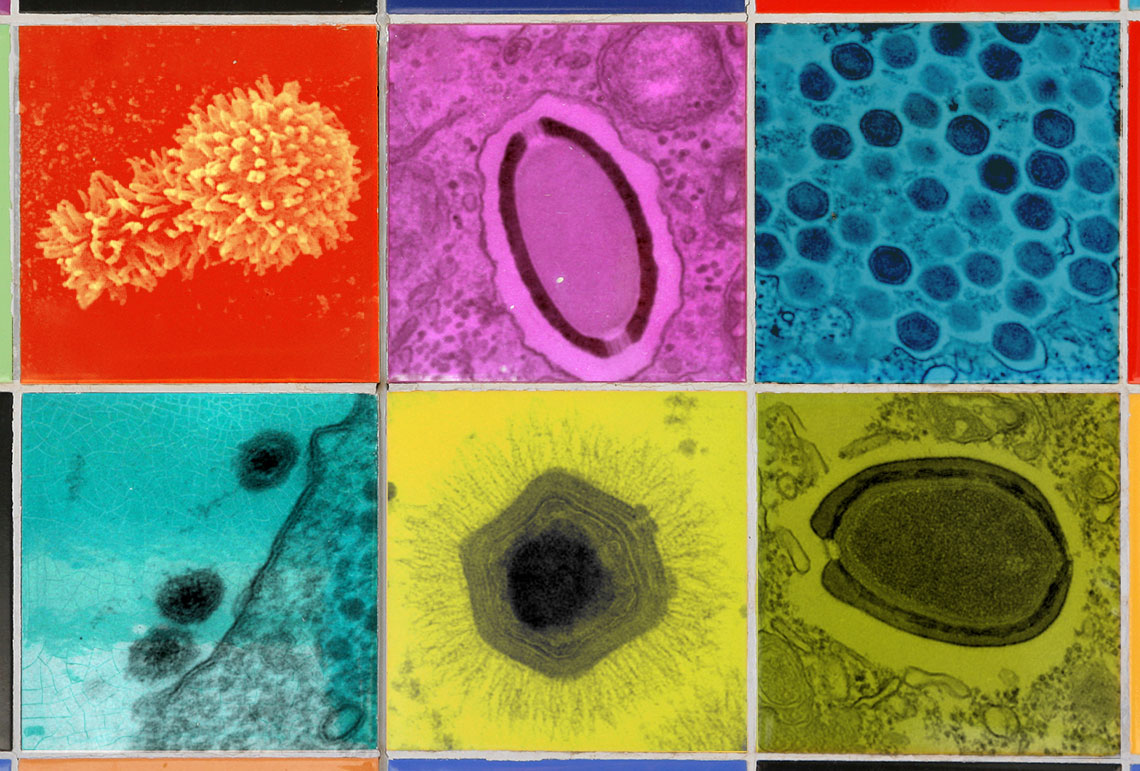
BORATTO, P. V. M. et al. VIRUSES. 2022Vírus isolados pela equipe da UFMG: (no alto, da esq. para a dir.) Tupanvírus, Cedratvírus, Marseillevírus, (abaixo) Yaravírus, Mimivírus e PandoravírusBORATTO, P. V. M. et al. VIRUSES. 2022
Aos seus alunos do curso de biologia na UFRJ, Cortines costuma dizer: “Só existimos graças aos vírus”. Ela argumenta que a proteína sincitina, envolvida no desenvolvimento da placenta e na interação do feto com o útero, assim permitindo a gestação, é produzida a partir de um gene de origem viral. Além disso, 8% do genoma humano provém dos vírus.
Os vírus ganham não só uma imagem mais amigável, mas também nomes mais completos. Em 2020, o ICTV determinou que os pesquisadores deveriam aplicar também aos vírus a nomenclatura binomial, com gênero e espécie, já adotada para animais e plantas. Até 2023, cerca de 10 mil espécies de vírus já identificados devem ter recebido os novos nomes.
“Até 20 anos atrás o universo dos vírus era bastante simples e só conhecíamos os patogênicos”, comenta Zerbini. “Foi a metagenômica que nos mostrou essa diversidade dos vírus.”
Nesse universo chamado virosfera, as espécies de gigantes não passam de poucas dezenas, mas exibem um genoma grande e flexível, em comparação com os vírus mais comuns, que faz os especialistas repensarem o papel deles entre os seres vivos. “O genoma deles tem plasticidade, pode crescer e encolher, como um acordeão, incorporando ou perdendo genes”, diz Abrahão.
Gigantes brasileiros
De uma amostra de água recolhida em 2011 do rio Negro, próximo a Manaus, a equipe da UFMG isolou um vírus gigante que ganhou o nome de Samba. Descrito em maio de 2014 em um artigo na Virology Journal, foi o primeiro vírus gigante identificado no Brasil.
Em 2017, foi a vez do Yaravírus, também da lagoa da Pampulha, com 80 nm e um genoma único. “Nenhum dos genes era igual ao dos outros vírus”, conta Abrahão.
Em um artigo de fevereiro de 2018 na Nature Communications, com colegas de Marselha, Paris, Belo Horizonte e Brasília, ele apresentou o Tupanvírus, coletado a 3 mil metros de profundidade do litoral do município de Campos de Goitacazes, no Rio de Janeiro, e de lagoas salinas no Pantanal. O maior entre os Mimivírus, com uma longa cauda dupla, o Tupanvírus tem um genoma de 1,4 a 1,5 milhão de pares de bases, maior que o de algumas bactérias, com as instruções para a produção de cerca de 1.300 proteínas. O genoma do vírus da gripe, formado por uma fita simples de RNA, codifica apenas 11 proteínas.
“O genoma do Tupanvírus é um mosaico, com genes de amebas, bactérias, outros vírus e mesmo de outros eucariotos [organismos unicelulares com núcleo], que são parasitas de protozoários”, diz Abrahão. Em um artigo publicado em janeiro na Viruses, a equipe da UFMG e da UFRJ apresentou os cerca de 200 vírus gigantes já identificados no Brasil – principalmente em Minas, mas também no Rio Grande do Sul e Rio Grande do Norte.
Artigos científicos
AZEVEDO, B. L. de et al. The discovery of a new Mimivirus isolate in association with virophage-transpoviron elements in Brazil highlights the main genomic and evolutionary features of this tripartite system. Viruses. v. 14, n. 2, p. 1-16. 21 jan. 2022.
LA SCOLA, B. et al. The virophage as a unique parasite of the giant Mimivirus. Nature. v. 455, n. 7209, p. 100-4. 4 set. 2008.
DESNUES, C. et al. Provirophages and transpovirons as the diverse mobilome of giant viruses. PNAS. v. 109, n. 44, p. 18078-83. 30 out. 2012.
OLIVEIRA, J. dos S. et al. Mimiviruses interfere with IκBα degradation. Frontiers in Virology. v. 2, art 908704, p. 1-10. 6 jun. 2021.
MÁRQUES, L. M. et al. A virus in a fungus in a plant: Three-way symbiosis required for thermal tolerance. Science. v. 315, n. 5811, p. 513-5. 25 jan. 2007.
CAMPO, R. K. et al. Samba virus: A novel Mimivirus from a giant rain forest, the Brazilian Amazon. Virology Journal. v. 11, n. 95. 14 mai. 2014.
ABRAHÃO, J. et al. Tailed giant Tupanvirus possesses the most complete translational apparatus of the known virosphere. Nature Communications. v. 9, n. 1, p. 1-12. 27 fev. 2018.
BORATTO, P. V. M. et al. A brief history of giant viruses’ studies in Brazilian biomes. Viruses. v. 14, n. 2, 191. 19 jan. 2022.
GUIMARÃES, A. J. et al. Acanthamoeba spp. as a universal host for pathogenic microorganisms: One bridge from environment to host virulence. Microbiological Research. v. 193, p. 30-8. dez. 2016.
Republicar