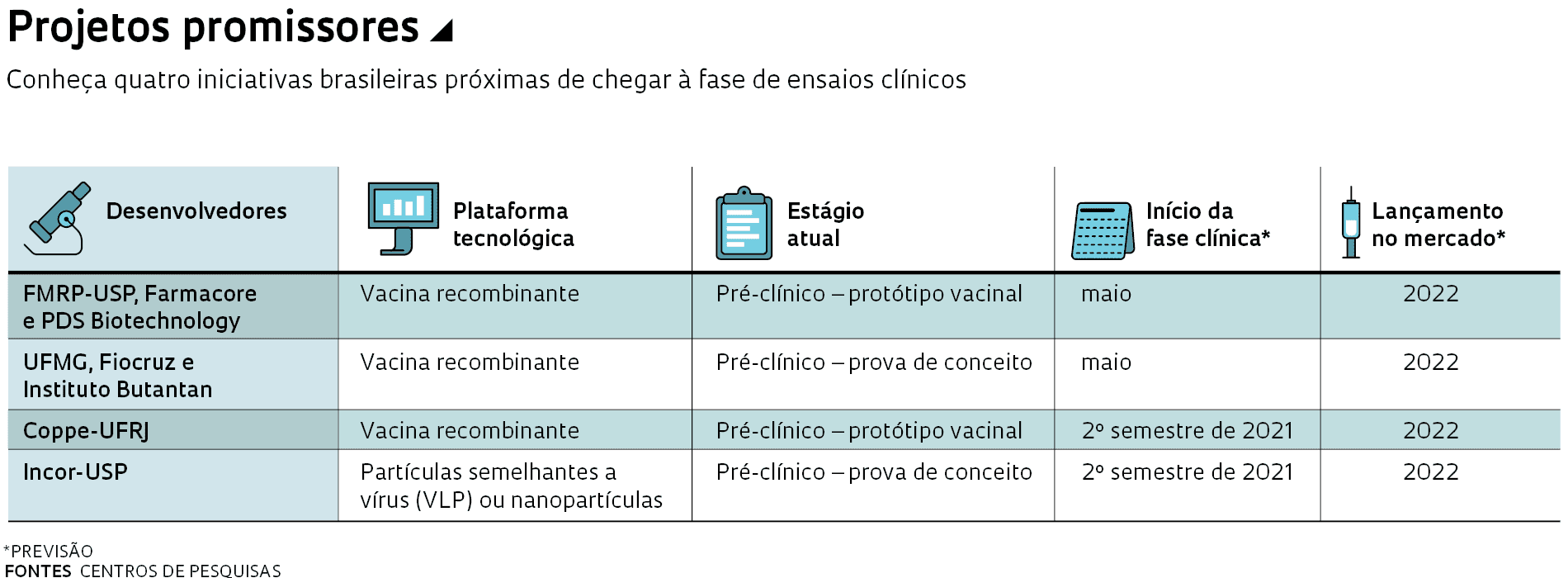
A ciência brasileira está empenhada em produzir uma vacina própria para a Covid-19, mas os desafios para atingir esse objetivo são enormes – e não se limitam à obtenção de recursos para apoiar o desenvolvimento dos imunizantes. Há cerca de 15 projetos de vacinas em andamento no país, sendo que pelo menos quatro deles devem iniciar nos próximos meses a fase de testes clínicos, em humanos. Uma característica comum dessas iniciativas, que ainda carecem de financiamento e precisam vencer uma série de obstáculos de ordem técnica e de produção para se viabilizar, é propor soluções tecnológicas capazes de fazer frente às constantes mutações do vírus.
A iniciativa brasileira mais adiantada é coordenada pela Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP), a startup paulista de biotecnologia Farmacore e o laboratório norte-americano PDS Biotechnology. Em meados de fevereiro, eles solicitaram à Agência Nacional de Vigilância Sanitária (Anvisa) autorização para o início do ensaio clínico da vacina Versamune-CoV-2FC. Avançam também outros três projetos, desenvolvidos pelo Instituto do Coração (InCor) da Faculdade de Medicina da USP (FM-USP), em São Paulo; pela Universidade Federal de Minas Gerais (UFMG), Fundação Oswaldo Cruz (Fiocruz), FMRP-USP e Instituto Butantan; e pela Universidade Federal do Rio de Janeiro (UFRJ).
Todos 15 os projetos estão na chamada fase pré-clínica ou laboratorial, quando são realizados ensaios de compostos promissores em bancada ou em animais, uma etapa que não demanda altos investimentos ou infraestrutura complexa. O caminho a ser trilhado até que as candidatas se transformem em uma vacina adequada para ser aplicada na população é longo – e não necessariamente terá um final feliz, pois a maioria fica pelo caminho.
– Estratégia de combate
– Emergentes sem fôlego
– O esperado efeito das vacinas
– Eurico Arruda: Um admirador dos vírus
A realização de ensaios clínicos, essenciais para comprovar a segurança e a eficácia das vacinas, depende de resultados positivos nos testes pré-clínicos e de recursos ainda não disponíveis. Cientistas ouvidos por Pesquisa FAPESP calculam que seriam necessários investimentos da ordem de R$ 300 milhões a R$ 400 milhões por projeto. Desse total, R$ 30 milhões custeiam os ensaios clínicos nas fases 1 e 2, quando as formulações são analisadas em grupos limitados de pessoas. Para a fase 3, em que a vacina é administrada em milhares de voluntários, estima-se um custo entre R$ 300 milhões e R$ 350 milhões.
O Ministério da Ciência, Tecnologia e Inovações (MCTI) solicitou um crédito extraordinário de R$ 400 milhões ao Ministério da Economia com essa finalidade. “É notório o empenho do MCTI em conseguir a verba, mas até agora não temos recursos assegurados”, afirma o imunologista Ricardo Tostes Gazzinelli, coordenador do Instituto Nacional de Ciência e Tecnologia de Vacinas (INCTV) e do Centro de Tecnologia de Vacinas da UFMG. Se confirmada a liberação dos recursos federais, o dinheiro seria suficiente para realizar os ensaios clínicos nas fases 1 e 2 de dois ou três projetos e os ensaios clínicos na fase 3 de apenas uma iniciativa.

Coppe-UFRJ
Pesquisador trabalha na produção da proteína S usada na vacina recombinante da UFRJCoppe-UFRJA maioria das plataformas de vacinas brasileiras contra Covid-19 conta com apoio do MCTI. A reportagem procurou o órgão para saber a relação de projetos apoiados, o valor dos investimentos feitos até o momento e se há previsão de liberação dos R$ 400 milhões adicionais para o programa, mas não obteve resposta até o fechamento desta edição.
A indefinição sobre financiamento é apenas um dos obstáculos para o desenvolvimento de uma vacina brasileira. Há outros tão ou mais importantes como a falta de centros tecnológicos especializados em imunobiológicos e unidades fabris que transformem as pesquisas em produtos finais, assim como o limitado know-how do país para produzir um imunizante completo, do estudo inicial em laboratório à fabricação em larga escala. A cadeia produtiva de medicamentos e vacinas no Brasil é falha, com pequeno número de empresas farmacoquímicas, essenciais para a produção do ingrediente farmacêutico ativo (IFA) – o principal insumo das vacinas –, e de laboratórios especializados para a realização de testes em animais (ver reportagem).
“Temos infraestrutura muito limitada para a produção de lotes-piloto em condição de boas práticas de fabricação, assim como para fazer testes pré-clínicos de segurança e para gerar bancos de sementes de células para produção industrial. Tudo isso é feito no exterior e não fica por menos de R$ 10 milhões por imunizante”, ressalta Gazzinelli. “Outro gargalo, a meu ver, diz respeito ao interesse de empresas farmacêuticas em projetos avançados de vacinas humanas. A fase 3 dos ensaios clínicos é muito cara e nossa indústria de imunizantes humanos é toda subsidiada pelo governo federal. Ela não tem recursos para investir nesse tipo de projeto, que pode ser muito rentável se for bem-sucedido, mas oferece um risco significativo de insucesso.”
Para avançar no desenvolvimento e iniciar os ensaios clínicos das fases 1 e 2, alguns projetos tentam obter recursos privados. É a estratégia adotada pelo Laboratório de Engenharia de Cultivos Celulares (Lecc) do Instituto Alberto Luiz Coimbra de Pós-graduação e Pesquisa em Engenharia (Coppe) da UFRJ, que conseguiu R$ 2 milhões do programa Fast Grants, um fundo de doadores criado nos Estados Unidos para financiar projetos de pesquisa voltados ao combate da Covid-19 no mundo. O Lecc busca parcerias com farmacêuticas brasileiras para a conclusão do desenvolvimento e a produção industrial.
O projeto fluminense usa a plataforma de vacina recombinante, em que o ingrediente ativo do imunizante é uma proteína obtida por técnicas de engenharia genética. A engenheira bioquímica Leda Castilho, coordenadora da iniciativa, relata que o Lecc já produz em escala-piloto a proteína S (spike) do Sars-CoV-2, cultivando células de mamíferos em biorreatores. A formulação final da vacina, em estágio de protótipo, contém a proteína recombinante associada a uma substância adjuvante para desencadear a resposta imunológica no organismo.

Farmacore-FMRP-USP
Cultura de células no laboratório da Farmacore, parceira da FMRP-USPFarmacore-FMRP-USP“O vacinado recebe a proteína igual à que está no vírus para estimular seu sistema imune e produzir anticorpos. Damos ao organismo a proteína pronta, enquanto as vacinas baseadas em mRNA [ácido ribonucleico mensageiro] ou em vetores virais procuram fazer com que o corpo passe a produzir a proteína S de forma a estimular o sistema imune”, explica.
Consideradas seguras, as vacinas recombinantes já são empregadas no combate à hepatite B, à gripe e ao HPV, o papilomavírus humano. No cronograma considerado ideal pelo Lecc, os testes pré-clínicos em animais serão concluídos ainda neste primeiro semestre. Caso sejam bem-sucedidos, os ensaios em humanos podem ser iniciados em seguida, havendo os recursos necessários para essa fase. Tudo dando certo, a vacina estaria apta para entrar em produção industrial em meados de 2022. “No Brasil existem fábricas que já produzem proteínas recombinantes. Elas poderiam ser adaptadas para a fabricação da vacina anti-Covid-19, sem necessidade de grandes investimentos em novas unidades industriais dedicadas”, avalia a cientista da Coppe.
Esse é um ponto importante para a viabilidade da produção nacional. Imunologistas como Gazzinelli destacam duas incertezas que permeiam o enfrentamento à Covid-19. A primeira é que não foram ainda reunidas informações suficientes sobre o ciclo de evolução do novo coronavírus, principalmente no que toca à sua capacidade de sofrer mutações e como elas afetam sua letalidade e transmissibilidade. A segunda é que não se sabe quanto tempo irá durar o efeito protetor das vacinas. A projeção dominante é que o vírus apresentará mutações constantes e conviverá na sociedade por muito tempo. Sendo assim, poderá demandar uma vacinação anual.
Outra possibilidade é o vírus não confirmar uma vocação de resiliência e a doença acabar eliminada mais rapidamente. Diante de um futuro incerto, é mais difícil motivar investimentos vultosos em uma nova fábrica de imunizantes que só entraria em operação em 2022, em um cenário otimista. Uma vacina que aproveite o parque fabril existente, como é o caso das plataformas recombinantes, poderia ajudar a solucionar essa equação. A empresa detentora do know-how poderia reestruturar sua produção, abrir novos turnos de trabalho, à noite ou nos fins de semana, e contratar pessoal para se dedicar à produção de vacinas para Covid-19.
Em Ribeirão Preto, no interior paulista, os coordenadores do projeto da FMRP-USP, da Farmacore e do PDS Biotechnology têm a expectativa de iniciar os estudos em humanos em maio. “O lote para os testes clínicos de fase 1 e 2 já está sendo produzido”, informa o imunologista Celio Lopes Silva, do Departamento de Bioquímica e Imunologia da FMRP-USP.
Léo Ramos Chaves
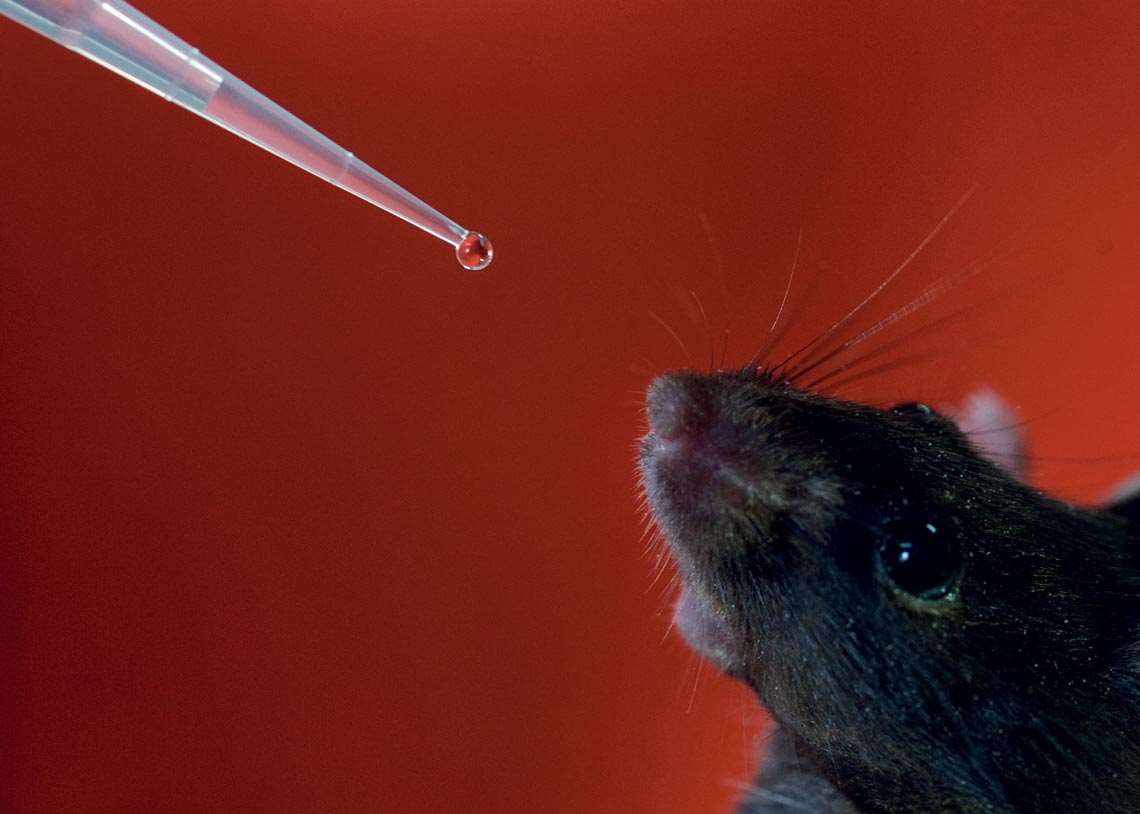
Formulação do InCor é testada em camundongo durante ensaio da fase pré-clínicaLéo Ramos ChavesA vacina também adota a plataforma recombinante. Emprega a proteína S1 do Sars-CoV-2 combinada com o carreador e imunomodulador Versamune, desenvolvido pelo laboratório PDS. A substância ativa linfócitos B e T, que têm funções imunológicas importantes nas infecções virais, e a imunidade inata. “É uma solução inovadora, que induz a geração de anticorpos neutralizantes e, ao mesmo tempo, confere potência à resposta imunológica, ativando todo o sistema de defesa celular, inclusive a produção de interferon do tipo I [IFN-I]”, destaca Silva. Interferons são glicoproteínas que atuam na proteção antiviral. O pesquisador tem a expectativa de que essa combinação – a geração de anticorpos contra a proteína S e ativação de linfócitos B e T e imunidade inata – ofereça uma imunização capaz de enfrentar as mutações do vírus.
A iniciativa recebeu uma subvenção do MCTI de R$ 3,8 milhões para a fase pré-clínica, e os desenvolvedores esperam incluir a vacina entre as contempladas com recursos para os ensaios clínicos, caso estes sejam viabilizados pelo ministério. O pesquisador informa que há uma negociação avançada para a transferência de tecnologia a uma empresa instalada no Brasil.
Outra iniciativa próxima do estágio de ensaios clínicos é desenvolvida pelo Laboratório de Imunologia do InCor. Segundo o imunologista Jorge Kalil, coordenador da pesquisa, a fase atual é de definição do protótipo vacinal por meio de testes em camundongos. Estão em análise dois vetores para o antígeno. Um envolve colocar uma proteína artificial com alvos para resposta de linfócitos B e T sintetizada em laboratório em nanopartículas condutoras; o outro utiliza a plataforma VLP (partículas semelhantes a vírus). Nesse caso, são usadas partes do vírus importantes para desencadear a resposta do sistema imunológico, mas sem o material genético.
A proposta é que a vacina seja aplicada via nasal ou oral, borrifada por meio de aerossóis. “Pretendemos fortalecer o sistema imunológico da mucosa do sistema respiratório, região onde ocorre o contágio”, ressalta Kalil. A expectativa do imunologista é que as provas de conceito com os animais sejam concluídas até junho. Se os resultados forem favoráveis, o início dos testes em humanos poderá ocorrer na segunda metade do ano. O projeto recebeu R$ 10,5 milhões do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e um financiamento de R$ 328 mil da FAPESP. As duas agências investiram, ainda, mais de R$ 7 milhões no Instituto Nacional de Ciência e Tecnologia de Investigação em Imunologia (INCT-Iii), coordenado por Kalil, que tem como uma de suas metas desenvolver novos imunizantes. Do total investido pela FAPESP, pouco mais de R$ 1 milhão já foi desembolsado, e o restante deve ser liberado até o final do projeto, previsto para 2023.