La ciencia brasileña se ha propuesto producir una vacuna nacional para el covid-19, pero los retos que plantea alcanzar ese objetivo son mayúsculos, y no se limitan a la obtención de los recursos para solventar el desarrollo de inmunizantes. En el país hay unos 15 proyectos de vacunas en marcha, y al menos cuatro iniciarán en los próximos meses la fase de ensayos clínicos en humanos. Una característica común de estas iniciativas, que aún carecen de financiación y deberán sortear una serie de obstáculos de índole técnica y de producción para ser factibles, reside en que proponen soluciones tecnológicas capaces de hacer frente a las constantes mutaciones del virus.
La investigación más avanzada es una coordinada conjuntamente por la Facultad de Medicina de Ribeirão Preto, de la Universidad de São Paulo (FMRP-USP), la startup paulista de biotecnología Farmacore y el laboratorio estadounidense PDS Biotechnology. A mediados de febrero, estas instituciones presentaron un pedido de autorización a la Agencia Nacional de Vigilancia Sanitaria (Anvisa) para dar comienzo a los ensayos clínicos de la vacuna Versamune-CoV-2FC. También están avanzados otros tres proyectos, desarrollados por el Instituto del Corazón (InCor) de la Facultad de Medicina de la USP (FM-USP), en São Paulo; la Universidad Federal de Minas Gerais (UFMG), la Fundación Oswaldo Cruz (Fiocruz), la FMRP-USP y el Instituto Butantan, y la Universidad Federal de Río de Janeiro (UFRJ), respectivamente.
Los 15 proyectos se encuentran en la fase denominada preclínica o de laboratorio, en la cual se realizan pruebas en las mesadas o en animales con compuestos prometedores, una etapa que no requiere de grandes inversiones o una infraestructura compleja. El camino que deberán recorrer las candidatas hasta transformarse en vacunas aptas para aplicárselas a la población es largo, y no necesariamente tendrá un final feliz, puesto que la mayoría de ellas quedan en el camino.
La realización de los ensayos clínicos, esenciales para comprobar la seguridad y la eficacia de las vacunas, depende de la obtención de resultados positivos en los test preclínicos y de recursos monetarios que hoy no están disponibles. Los científicos consultados por Pesquisa FAPESP estiman que serían necesarias inversiones del orden de 300 a 400 millones de reales por proyecto. De ese total, 30 millones son lo que cuestan los ensayos clínicos de las fases I y II, cuando las distintas fórmulas se evalúan en grupos limitados de personas. Para la fase III, en la cual se inocula la vacuna a miles de voluntarios, el costo estipulado fluctúa entre 300 y 350 millones de reales.
El Ministerio de Ciencia, Tecnología e Innovación (MCTI) ha solicitado un crédito extraordinario de 400 millones de reales al Ministerio de Economía para ese propósito. “El empeño del MCTI para conseguir los fondos es encomiable, pero por ahora no tenemos los recursos asegurados”, dice el inmunólogo Ricardo Tostes Gazzinelli, coordinador del Instituto Nacional de Ciencia y Tecnología de Vacunas (INCTV) y del Centro de Tecnología de Vacunas de la UFMG. Si se aprueba la concesión de los recursos federales, ese dinero sería suficiente como para realizar los ensayos clínicos de las fases I y II de dos o tres proyectos y uno de fase III de tan solo una de las iniciativas.

COPPE-UFRJ
Un investigador trabajando en la producción de la proteína S, que se utiliza en la vacuna recombinante de la UFRJCOPPE-UFRJLa mayoría de las plataformas de las vacunas brasileñas contra el covid-19 cuentan con el respaldo del MCTI. Para elaborar este reportaje se consultó a ese organismo a los efectos de conocer la lista de los proyectos subvencionados, el monto de las inversiones realizadas hasta el momento y si está previsto el giro de los 400 millones de reales adicionales destinados al programa, pero hasta el cierre de esta edición no se había recibido una respuesta.
La indefinición con respecto a la financiación es tan solo uno de los obstáculos para el desarrollo de una vacuna brasileña. Hay otros tanto o más importantes, tales como la falta de centros de tecnología especializados en inmunobiológicos y plantas fabriles que puedan transformar las investigaciones en productos finales, así como el limitado know-how del país para producir totalmente una vacuna, desde el estudio inicial en un laboratorio hasta la producción a gran escala. En Brasil, la cadena productiva de medicamentos y vacunas es endeble, con un pequeño número de empresas farmacoquímicas esenciales para la producción del ingrediente farmacéutico activo (IFA) –el insumo principal de las vacunas–, y de laboratorios especializados en la realización de pruebas en animales (lea el reportaje en la página 28).
“La infraestructura disponible es muy limitada para la producción de lotes piloto ajustados a las buenas prácticas de fabricación, así como para la realización de los test preclínicos de seguridad o para generar bancos de cultivos celulares destinados a la producción industrial. Todo eso se hace en el exterior y su costo no baja de 10 millones de reales por inmunizante”, subraya Gazzinelli. “Otro escollo, en mi opinión, tiene que ver con el interés de las empresas farmacéuticas en proyectos avanzados de vacunas humanas. La fase III de los ensayos clínicos es muy cara y toda nuestra industria de inmunizantes humanos es subsidiada por el gobierno federal, porque no cuenta con recursos para invertir en este tipo de proyectos, que podrían ser muy rentables si fueran exitosos, pero el riesgo de fracaso es significativo”.
Para avanzar en el desarrollo y comenzar con los ensayos clínicos de las fases I y II, algunos proyectos apuntan a obtener recursos privados. Esta es la estrategia que adoptó el Laboratorio de Ingeniería en Cultivos Celulares (Lecc, por sus siglas en portugués) del Instituto Alberto Luiz Coimbra de Posgrado e Investigación en Ingeniería (Coppe, según las antiguas siglas originales en portugués del organismo) de la UFRJ, que ha conseguido 2 millones de reales del programa Fast Grants, un fondo de donaciones creado en Estados Unidos para la financiación de proyectos de investigación científica centrados en la lucha contra el covid-19 en todo el mundo. El Lecc está buscando asociarse con empresas farmacéuticas brasileñas para completar el desarrollo y la producción industrial.
El proyecto fluminense utiliza una plataforma de vacuna recombinante, en la cual el principio activo del agente inmunizante es una proteína que se obtiene mediante técnicas de ingeniería genética. La ingeniera bioquímica Leda Castilho, quien coordina la iniciativa, informa que el Lecc ya está produciendo la proteína S (spike o espícula) del Sars-CoV-2, mediante el cultivo de células de mamíferos en biorreactores. La fórmula final de la vacuna, actualmente en fase de prototipo, contiene una proteína recombinante asociada a una sustancia adyuvante para desencadenar una respuesta inmunológica en el organismo.

Farmacore-FMRP-USP
Al lado, cultivo de células en el laboratorio de Farmacore, una empresa colaboradora de la FMRP-USPFarmacore-FMRP-USP“La persona vacunada recibe una proteína igual a la del virus para estimular a su sistema inmunológico y producir anticuerpos. Le proporcionamos al organismo la proteína lista, mientras que las vacunas basadas en ARNm [ácido ribonucleico mensajero] o en vectores virales buscan que el cuerpo produzca la proteína S para estimular al sistema inmunológico”, explica.
Las vacunas recombinantes son consideradas seguras y ya se las emplea para combatir la hepatitis B, la gripe y el VPH, el virus del papiloma humano. Según el cronograma que el Lecc considera ideal, los test preclínicos en animales se completarán durante este primer semestre del año y, si resultan exitosos, podrían comenzar luego los ensayos en humanos, siempre que haya los recursos necesarios para esta fase. Si todo sale bien, la vacuna estaría lista para la etapa de producción industrial a mediados de 2022. “En Brasil ya existen fábricas que producen proteínas recombinantes y se las podría adaptar para elaborar la vacuna contra el covid-19 sin necesidad de realizar grandes inversiones en nuevas unidades industriales específicas”, estima el científico de la Coppe.
Este es un punto importante para la viabilidad de la producción nacional. Gazzinelli y otros inmunólogos hacen hincapié en dos incertidumbres que caracterizan la lucha contra el covid-19. La primera es que aún no se ha reunido información suficiente sobre el ciclo de evolución del nuevo coronavirus, especialmente en lo que atañe a su capacidad de experimentar mutaciones y cómo afectan estas a su letalidad y su transmisibilidad. La segunda es que no se sabe cuánto durará el efecto protector de las vacunas. La perspectiva dominante indica que el virus mutará constantemente y perdurará en la sociedad durante mucho tiempo. Por lo tanto, podría ser necesaria una vacunación anual.
Otra posibilidad es que el virus finalmente no tenga tanta resiliencia y la enfermedad acabe siendo eliminada más rápidamente. Frente a un futuro incierto, es más difícil impulsar grandes inversiones en una nueva planta de inmunizantes que solo entraría en funcionamiento en 2022, y esto en un escenario optimista. Una vacuna que aproveche el parque industrial existente, como es el caso de las plataformas recombinantes, podría ayudar a resolver esta ecuación. Toda empresa que posea el know-how requerido podría reestructurar su producción, sumar nuevos turnos nocturnos o los fines de semana, y contratar personal para que se dedique a producir las vacunas contra el covid-19.
En Ribeirão Preto, en el interior del estado de São Paulo, los coordinadores del proyecto de la FMRP-USP, Farmacore y PDS Biotechnology esperan comenzar los estudios en humanos en el mes de mayo. “Ya se está produciendo el lote para los ensayos clínicos de fase I y II”, informa el inmunólogo Celio Lopes Silva, del Departamento de Bioquímica e Inmunología de la FMRP-USP.
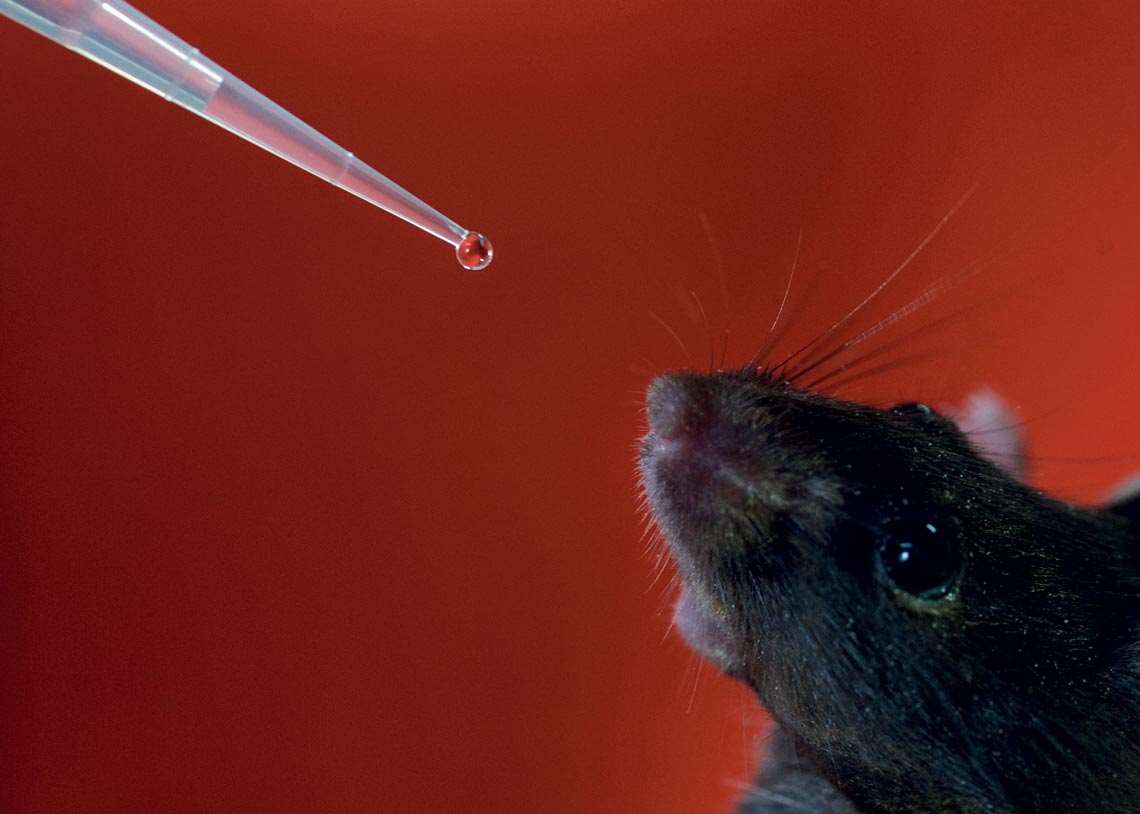
Léo Ramos Chaves
Prueba de la fórmula del InCor en un ratón, durante los test de la fase preclínicaLéo Ramos ChavesLa vacuna también adopta la plataforma recombinante. Emplea la proteína S1 del Sars-CoV-2 combinada con el cargador e inmunomodulador Versamune, desarrollado por el laboratorio PDS. La sustancia activa a los linfocitos B y T, que tienen importantes funciones inmunológicas en las infecciones virales, y a la inmunidad innata. “Se trata de una solución innovadora que induce la generación de anticuerpos neutralizantes y, al mismo tiempo, dota de potencia a la respuesta inmunitaria, activando todo el sistema de defensa celular, incluyendo la producción de interferón tipo I [IFN-I]”, resalta Lopes Silva. Los interferones son glucoproteínas que intervienen en la protección antiviral. El investigador espera que esta combinación –la generación de anticuerpos contra la proteína S y la activación de los linfocitos B y T y la inmunidad innata– genere una inmunidad capaz de hacer frente a las mutaciones del virus.
La iniciativa recibió un subsidio de 3,8 millones de reales del MCTI para la fase preclínica, y los desarrolladores esperan poder incluir la vacuna entre las contempladas con recursos para los ensayos clínicos, si finalmente el ministerio así lo dispone. El inmunólogo apunta que hay una negociación avanzada para la transferencia de tecnología a una empresa instalada en Brasil.
Otra iniciativa próxima a la fase de ensayos clínicos es la desarrollada por el Laboratorio de Inmunología del InCor. Según el inmunólogo Jorge Kalil, coordinador de la investigación, en la fase actual están definiendo el prototipo de la vacuna mediante pruebas en ratones. Se están analizando dos vectores para el antígeno. Uno de ellos comprende la colocación en nanopartículas conductoras de una proteína artificial sintetizada en laboratorio, con blancos para la respuesta de los linfocitos B y T; el otro utiliza la plataforma VLP (partículas similares a un virus, por sus siglas en inglés). En este caso, se utilizan partes del virus desprovistas de su material genético, que son importantes para desencadenar la respuesta del sistema inmunológico.
La idea es que la vacuna pueda aplicarse por vía nasal u oral bajo el formato de un aerosol. “Nos proponemos reforzar el sistema inmunológico de la mucosa del sistema respiratorio, que es donde se produce el contagio”, subraya Kalil. Él espera que las pruebas de concepto con animales estén concluidas en junio. Si los resultados son favorables, el inicio de los ensayos en humanos podría concretarse en la segunda mitad del año. El proyecto recibió 10,5 millones de reales del Consejo Nacional de Desarrollo Científico y Tecnológico (CNPq) y la FAPESP aportó 328 mil reales. Ambas agencias también invirtieron más de 7 millones de reales en el Instituto Nacional de Ciencia y Tecnología de Investigación en Inmunología (INCT-Iii), coordinado por Kalil; una de sus metas es el desarrollo de nuevos inmunizantes. Del total invertido por la FAPESP, ya se ha desembolsado algo más de 1 millón de reales, y el resto estará disponible hacia el final del proyecto, previsto para 2023.
El Centro de Tecnología de Vacunas de la UFMG trabaja simultáneamente en dos plataformas, desarrolladas en el ámbito del Instituto Nacional de Ciencia y Tecnología de Vacunas (INCTV), que recibieron 3,7 millones de reales del MCTI. Una de las propuestas, desarrolladas en conjunto con la Fiocruz y la FMRP-USP, es una vacuna recombinante que emplea las proteínas S y N de la nucleocápsida viral del Sars-CoV-2. “La proteína S se expresa en la superficie del virus y es blanco de los anticuerpos, y la proteína N se expresa en mayor cantidad en las células infectadas y es un objetivo importante para los linfocitos T”, dice Gazzinelli. Los genes que codifican los segmentos de ambas proteínas se fusionaron generando una proteína recombinante quimera, que se inyecta combinada con adyuvantes.
La segunda plataforma, concebida en colaboración con la Fiocruz y el Instituto Butantan, cuenta con el respaldo de la FAPESP. Se trata de una vacuna recombinante Flu-CoV, que utiliza el virus de la gripe H1N1 modificado genéticamente. El antígeno se produce con la combinación de las proteínas S del nuevo coronavirus y la hemaglutinina de la gripe estacional. “La hemaglutinina induce el ingreso del virus en la célula y la neuraminidasa [una enzima que se utilizó en la fórmula] es importante para su salida de la misma. Eliminamos el gen que codifica la neuraminidasa y, en su lugar, insertamos otro que codifica el segmento de la proteína S. El virus se introduce y expresa sus proteínas, pero no sale de la célula hospedadora y, siendo así, induce una respuesta inmunitaria sin replicarse”, explica Gazzinelli. La idea es aplicar la vacuna en aerosol. Una ventaja consiste en que podría permitir un uso híbrido, combatiendo al covid-19 y a la gripe.
Las pruebas de inmunogenicidad de ambas vacunas, que se encuentran en la fase final de prueba de concepto, apuntaron una fuerte respuesta celular y humoral contra las proteínas del Sars-CoV-2. Si todo va bien, los ensayos clínicos comenzarán en mayo. Se espera poder tener una vacuna lista para 2022. “Esta es una pandemia que no va a desaparecer pronto. Es importante disponer de una tecnología nacional capaz de responder rápidamente a las mutaciones del virus que se han producido en Brasil y en todo el mundo”, dice Gazzinelli.
Proyectos
1. Mapeo de epítopos del virus Sars-CoV-2 para los linfocitos T y del receptor de la proteína spike para los linfocitos B (nº 20/05256-7); Modalidad Ayuda de Investigación – Regular; Investigador responsable Jorge Elias Kalil Filho (USP); Inversión R$ 328.435,51
2. Vacuna intranasal bivalente utilizando el virus influenza que expresa la proteína S (spike) del Sars-CoV-2: Mecanismos de protección y lesión pulmonar (nº 20/05527-0); Modalidad Ayuda de investigación – Regular; Investigador responsable Ricardo Tostes Gazzinelli; Inversión R$ 182.189,86
3. INCT 2014: Investigación en inmunología (nº 14/50890-5); Modalidad Proyecto Temático; Convenio CNPq-INCT; Investigador responsable Jorge Elias Kalil Filho (USP); Inversión R$ 3.996.152,01