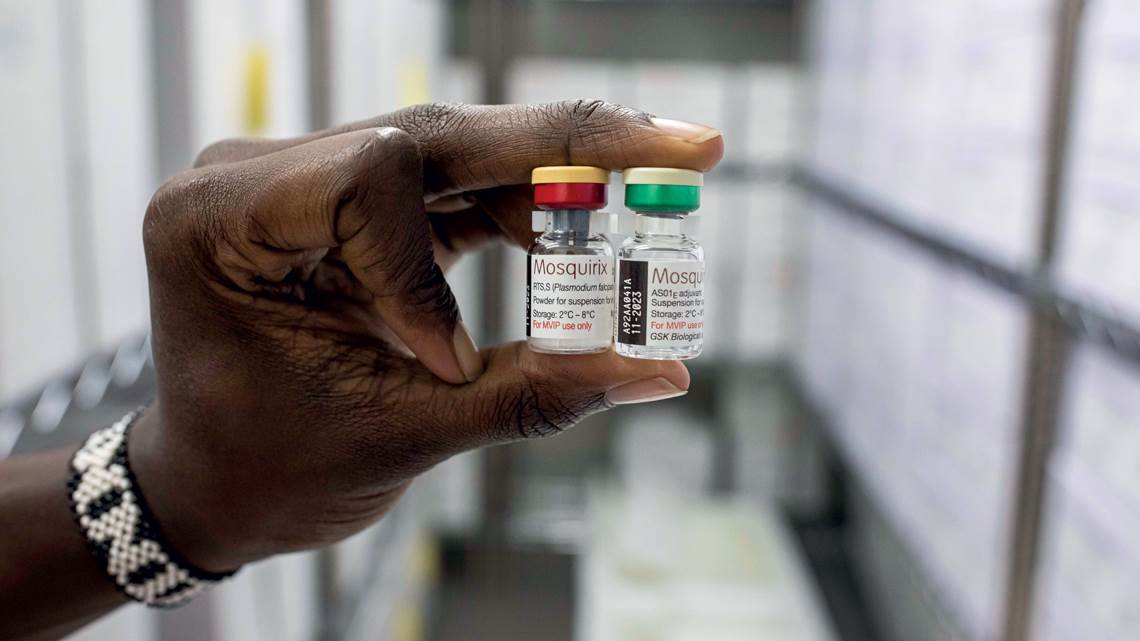
Em uma decisão histórica, a Organização Mundial da Saúde (OMS) veio a público, em 6 de outubro de 2021, recomendar a adoção de uma vacina contra a malária para crianças em regiões com alta ocorrência da doença, como a África Subsaariana. O anúncio é resultado de mais de 50 anos de estudos em busca de uma forma de imunização contra a enfermidade que mata, anualmente, 410 mil pessoas, das quais 260 mil crianças com menos de 5 anos. Quase 95% dos óbitos ocorrem na África.
A vacina recomendada, a RTS,S/AS01, comercialmente batizada de Mosquirix, age contra o parasita Plasmodium falciparum, que causa a forma mais letal da malária e é o mais prevalente no continente africano. Ela foi testada em um programa-piloto que alcançou mais de 800 mil crianças em Gana, no Quênia e no Malaui desde 2019. A imunização ocorre com a aplicação de quatro doses: a primeira aos 5 meses de vida, a segunda aos 8 meses, a terceira aos 11 meses e a quarta dose, de reforço, aos 18 meses.
Os resultados do estudo-piloto revelaram uma proteção de 39% contra o aparecimento de novos casos de malária e de 29% contra as ocorrências graves. Embora a eficácia da vacina isoladamente seja baixa, houve ganhos significativos quando o imunizante foi empregado ao lado de outras intervenções. O uso combinado da Mosquirix com medicamentos antimaláricos, administrados nas épocas do ano em que há maior ocorrência de casos, resultou em uma queda de mais de 70% nas internações por quadros graves e no número de mortes, de acordo com trabalho publicado por pesquisadores da Escola de Higiene e Medicina Tropical de Londres no New England Journal of Medicine. Os dados reforçam o papel da imunização como estratégia adicional ao combate de P. falciparum na África. A vacina integrará um pacote de medidas de saúde pública que já conta com testagem rápida, distribuição de medicamentos antimaláricos, uso de inseticida contra o mosquito Anopheles (transmissor do parasita da malária) e de mosquiteiros na hora de dormir.
Em comunicado à imprensa e investidores, a farmacêutica GlaxoSmithKline (GSK), desenvolvedora da vacina, que já forneceu 10 milhões de doses da Mosquirix para estudos-piloto, comprometeu-se a disponibilizar 15 milhões de doses anuais do imunizante a um valor apenas 5% acima dos custos de produção. A empresa também concordou em transferir a tecnologia para produção do antígeno empregado na vacina para a farmacêutica Bharat Biotech, da Índia.
“Este é um momento histórico. A tão esperada vacina contra a malária para crianças é um avanço para a ciência, a saúde infantil e o controle da doença”, declarou o diretor-geral da OMS, Tedros Adhanom Ghebreyesus. “Usar essa vacina, além das ferramentas existentes para prevenir a malária, pode salvar a vida de dezenas de milhares de jovens a cada ano.”
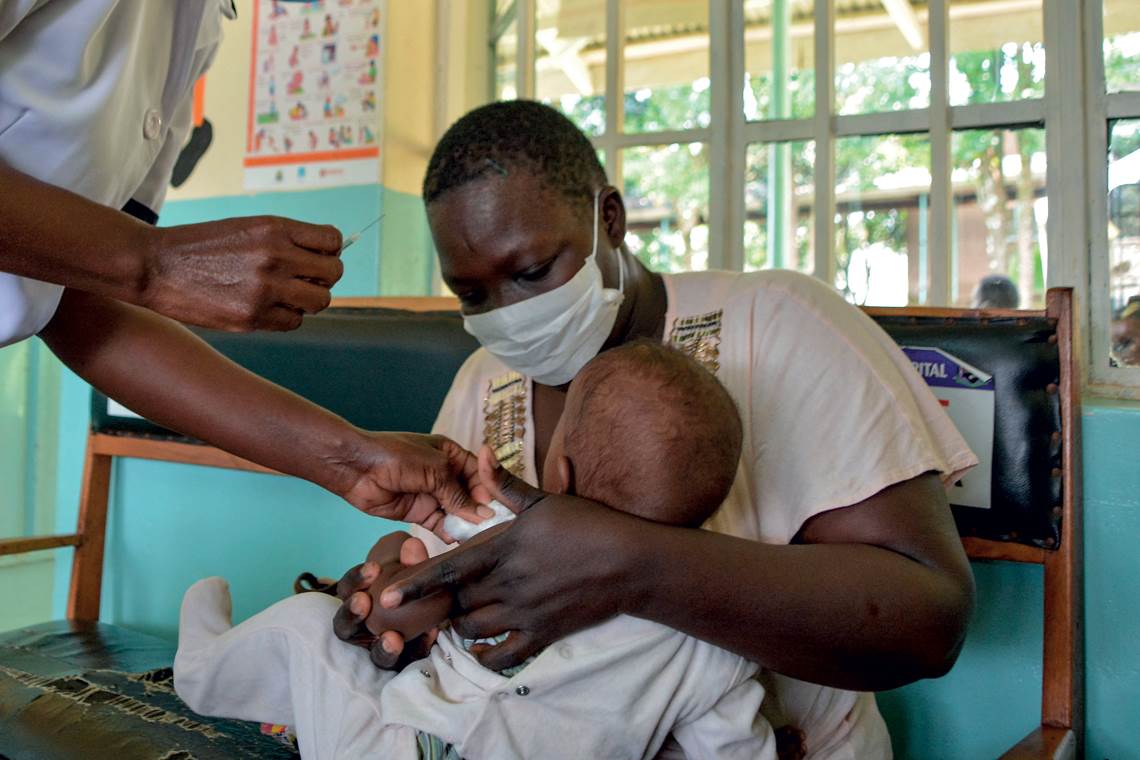
Brian Ongoro / AFP via Getty Images
Os testes da vacina da GSK foram feitos em 800 mil crianças africanasBrian Ongoro / AFP via Getty ImagesUm estudo publicado na PLOS Medicine em novembro de 2020 aponta que a aplicação anual de 30 milhões de doses da vacina nos países africanos mais acometidos pela malária poderia evitar algo em torno de 4,3 milhões de novos casos e salvar a vida de 22 mil de crianças com 5 anos ou menos. A eficácia da vacina se mantém por aproximadamente cinco anos. Outras versões do imunizante também estão em testes em adultos.
Raízes no Brasil
Os avanços da Mosquirix não devem, por ora, impactar a saúde pública brasileira. Por aqui, a malária, além de estar controlada, é mais amena e causada majoritariamente por outro parasita, Plasmodium vivax, que não é alvo do novo imunizante. O Brasil, contudo, tem uma íntima ligação com a vacina recentemente chancelada pela OMS.
Essa história começa na década de 1960, quando um casal de pesquisadores brasileiros, Ruth (1928-2018) e Victor Nussenzweig, trabalhando na Universidade de Nova York (NYU), nos Estados Unidos, dedicou-se a investigar o parasita da malária africana a fim de identificar maneiras de ativar anticorpos sensíveis a eles em organismos infectados.
O casal focava suas observações no estágio de desenvolvimento em que o parasita é semelhante a um esporo (esporozoíto) e é inoculado no sangue pelo mosquito. De acordo com Sergio Schenkman, do Laboratório de Biologia Molecular e Celular de Parasitas da Universidade Federal de São Paulo (Unifesp), os Nussenzweig iniciaram os estudos com esporozoítos de P. falciparum construindo um insetário nos laboratórios da NYU. “Eles mantinham uma colônia de Anopheles e começaram a expor os mosquitos à radiação. Depois, induziam os insetos a picar camundongos”, descreve o microbiologista, que ouviu esses relatos do casal quando estagiou no New York University Medical Center sob supervisão de Victor, no fim dos anos 1980.
“Ruth Nussenzweig foi a primeira pesquisadora a demonstrar, em um trabalho publicado na Nature, em 1967, que a imunização com esporozoítos inativados com raios X era capaz de induzir imunidade protetora contra a infecção em camundongos”, destaca Irene da Silva Soares, do Departamento de Análises Clínicas e Toxicológicas da Faculdade de Ciências Farmacêuticas da Universidade de São Paulo (FCF-USP). “Posteriormente, Ruth, Victor e seus colaboradores mostraram na Science, em 1984, como isolaram o gene que codifica a proteína que reveste os esporozoítos, chamada CSP.” Essa proteína, que ativa a resposta imune contra a malária, é a base da vacina recentemente aprovada. “Por isso, ambos podem ser considerados ‘os pais’ da vacina contra a malária. Do meu ponto de vista, foram estudos dignos de Prêmio Nobel”, declara a parasitologista da USP.

J R Ripper / Brazil Photos / LightRocket via Getty Images
O uso de telas de proteção dificulta a transmissão do parasita da malária pelo mosquito Anopheles J R Ripper / Brazil Photos / LightRocket via Getty ImagesA vacina contra a malária é a primeira desenvolvida para proteger humanos contra uma infecção causada por parasitas e levou décadas para tornar-se viável em razão de diversos complicadores. Para fins de comparação com doenças e vacinas recentes e amplamente debatidas, P. falciparum tem mais de 5 mil genes enquanto o Sars-CoV-2, o vírus da Covid-19, tem apenas 12. “Os parasitas têm um ciclo de vida complexo, envolvendo várias fases morfológicas e mudanças do ambiente no qual se desenvolvem dentro do corpo humano. Além disso, adotaram várias maneiras de escapar do sistema imunológico do hospedeiro. No caso da malária, é um grande desafio para os pesquisadores encontrar um alvo para desenvolver a vacina, já que o parasita apresenta alto grau de polimorfismo genético”, explica Célia Regina da Silva Garcia, também da FCF-USP.
Silvia Beatriz Boscardin, do Departamento de Parasitologia do Instituto de Ciências Biomédicas da USP (ICB-USP), complementa o raciocínio da colega. “Além de terem um genoma bem maior que o dos vírus, os parasitas podem se reproduzir em diferentes hospedeiros, tanto vertebrados quanto invertebrados, e apresentam formas de desenvolvimento distintas. Essas formas normalmente expressam proteínas diferentes”, diz Boscardin. “Tudo isso torna o desenvolvimento de uma vacina contra parasitas uma tarefa bem mais complicada.”
Mesmo com tamanho desafio, o grupo de pesquisa de Soares vem desenvolvendo, desde 2008, com apoio da FAPESP, uma vacina contra a forma de malária que mais ocorre no Brasil, causada por P. vivax. O projeto é herança de um ex-aluno de Ruth Nussenzweig, o imunologista Maurício Martins Rodrigues, que foi docente da Unifesp e era casado com Soares (Rodrigues faleceu em 2015). A formulação também é baseada na CSP, que, em P. vivax, apresenta uma complexidade adicional: o parasita tem três variantes geneticamente distintas, dispersas pelo mundo. “Nosso objetivo é desenvolver uma vacina universal, que cubra toda essa diversidade genética de P. vivax”, comenta Soares.
Segundo a pesquisadora, há grupos nos Estados Unidos e no Reino Unido tentando desenvolver vacinas semelhantes. Mas a de seu grupo seria a única que procura induzir imunidade protetora contra as três variantes do parasita, conforme estudo publicado este ano na Scientific Reports. “Os testes pré-clínicos já foram finalizados e demonstraram que a formulação gera resposta imunológica e não induz efeitos adversos significativos em camundongos e em coelhos. Em breve vamos submeter a documentação para a Anvisa e pedir a autorização para realizar testes clínicos de fase 1, em pessoas”, diz a pesquisadora da FCF-USP.
Outro horizonte que se abre para as vacinas antimaláricas – atualmente há mais de 140 sendo desenvolvidas mundo afora – tem a ver com os avanços tecnológicos recentemente estimulados pela pandemia da Covid-19. Para Soares, novas estratégias, como as vacinas de mRNA e de vetores virais baseados em adenovírus, estão gerando um conhecimento que será aplicado para melhorar imunizantes já existentes ou em desenvolvimento. “Estratégias de vacinação utilizando uma combinação de diferentes vacinas já vêm sendo testadas em um modelo experimental de malária desde os anos 1990 pelo grupo que era chefiado pela Ruth Nussenzweig”, exemplifica Soares. “Temos em mãos adenovírus recombinantes baseados na proteína CSP de P. vivax, que podem ser utilizados, se necessário, para intensificar a resposta imune da vacina que estamos desenvolvendo.”
Projeto
Geração e análise da imunogenicidade de proteínas recombinantes baseadas nas diferentes formas alélicas do antígeno circumsporozoíta de Plasmodium vivax visando o desenvolvimento de uma vacina universal contra malária (n° 12/13032-5): Modalidade Projeto Temático; Pesquisadora responsável Irene da Silva Soares (USP); Investimento R$ 16.167.637,14.
Artigos científicos
CHANDRAMOHAN, D. et al. Seasonal malaria vaccination with or without seasonal malaria chemoprevention. New England Journal of Medicine. 9 set. 2021.
HOGAN, A.B. et al. Estimated impact of RTS,S/AS01 malaria vaccine allocation strategies in sub-Saharan Africa: A modelling study. PLoS Medicine. 30 nov. 2020.