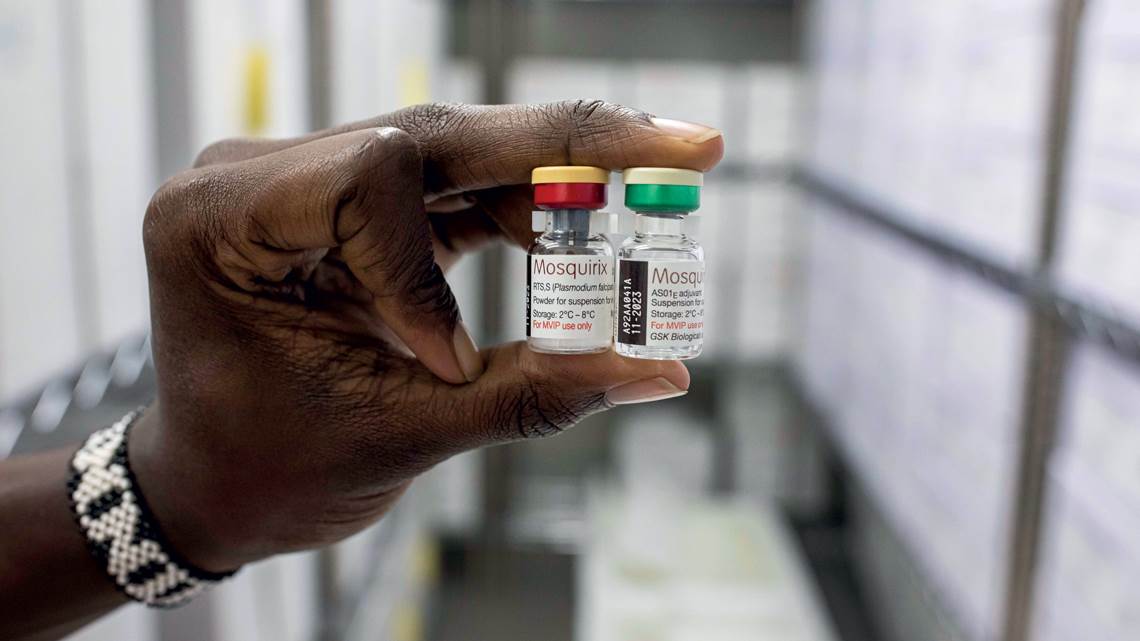
En una decisión histórica, la Organización Mundial de la Salud (OMS) hizo pública, el 6 de octubre de 2021, la recomendación de adoptar la vacuna contra la malaria para los niños de las regiones en donde la incidencia de la enfermedad es alta, como es el caso del África Subsahariana. El anuncio es el resultado de más de 50 años de estudios en busca de una forma de lograr la inmunización contra la enfermedad, que anualmente mata a 410.000 personas, de las cuales 260.000 son niños menores de 5 años. Casi el 95 % de los decesos se producen en África.
La vacuna recomendada, cuya denominación de serie es RTS,S/AS01 y que ha sido bautizada comercialmente con el nombre de Mosquirix, actúa contra el parásito Plasmodium falciparum, que causa la forma más letal del paludismo y es la más prevalente en el continente africano. Se la ha probado en un programa piloto que ha llegado a más de 800.000 niños en Ghana, Kenia y Malaui desde 2019. La inmunización se logra tras la aplicación de cuatro dosis: la primera a los 5 meses de vida, la segunda a los 8 meses, la tercera a los 11 meses y la cuarta dosis, de refuerzo, a los 18 meses.
Los resultados del estudio piloto revelaron una protección de un 39 % contra el surgimiento de nuevos casos de malaria o paludismo, y de un 29 % contra los casos graves. Aunque la efectividad de la vacuna, por sí sola, es baja, se han registrado mejoras significativas al combinarla con otros fármacos. El uso combinado de Mosquirix con medicamentos antipalúdicos, suministrados en las épocas del año en que se producen más casos, dio lugar a un descenso de más del 70 % en las internaciones por cuadros graves y en el número de muertes, según un estudio publicado por investigadores de la Escuela de Higiene y Medicina Tropical de Londres en la revista New England Journal of Medicine. Estos datos refuerzan el papel de la inmunización como estrategia adicional en la lucha contra P. falciparum en el continente africano. La vacuna formará parte de un paquete de medidas de salud pública que ya incluye el testeo rápido, la distribución de medicamentos antipalúdicos, el uso de insecticidas contra el mosquito Anopheles (vector del parásito que provoca la malaria) y de mosquiteros a la hora de dormir.
En un comunicado destinado a la prensa y a los inversores, la compañía farmacéutica GlaxoSmithKline (GSK), desarrolladora de la vacuna, que ya ha provisto 10 millones de dosis de Mosquirix para los estudios piloto, se comprometió a entregar 15 millones de dosis anuales del inmunógeno a un valor de tan solo un 5 % por sobre los costos de producción. La empresa también acordó transferir la tecnología para la producción del antígeno empleado en la vacuna a la empresa farmacéutica Bharat Biotech de la India.
“Este es un acontecimiento histórico. La tan esperada vacuna contra el paludismo para niños representa un avance para la ciencia, la salud infantil y el control de la enfermedad”, declaró el director general de la OMS, Tedros Adhanom Ghebreyesus. “El uso de esta vacuna, además de las herramientas existentes para la prevención de la malaria, puede salvarles la vida a decenas de miles de jóvenes cada año”.
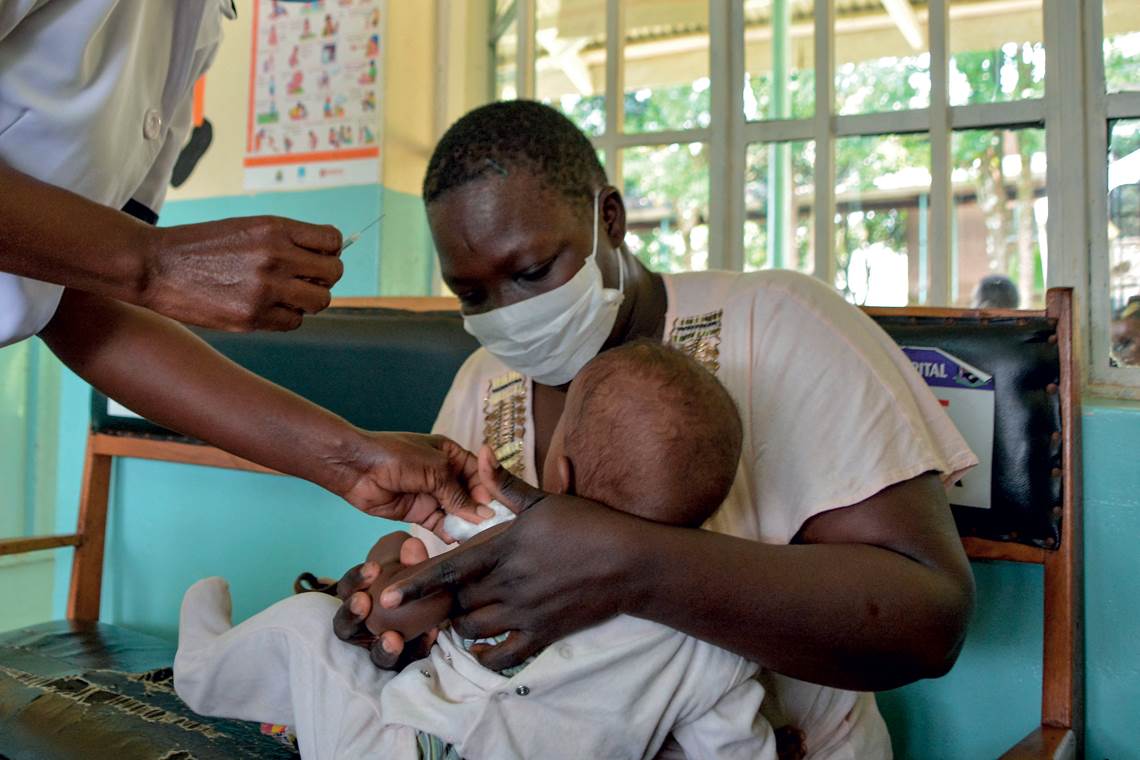
Brian Ongoro / AFP vía Getty Images
Los ensayos de la vacuna de GSK se realizaron con 800.000 niños africanosBrian Ongoro / AFP vía Getty ImagesUn estudio publicado en la revista PLOS Medicine en noviembre de 2020 indica que la aplicación anual de 30 millones de dosis de la vacuna en los países africanos más afectados por el paludismo podría evitar alrededor de 4,3 millones de casos nuevos y salvarles la vida a 22.000 menores de 5 años. La eficacia de la vacuna se mantiene durante aproximadamente cinco años. También se están probando otras versiones del agente inmunizante en adultos.
Raíces en Brasil
Los avances con la vacuna Mosquirix por ahora no tendrán impacto en la salud pública brasileña. En Brasil, el paludismo, además de estar controlado, se cursa en forma más leve y, predominantemente, es causado por otro parásito, el Plasmodium vivax, que no es el blanco del nuevo inmunógeno. Con todo, Brasil está vinculado íntimamente con la vacuna recientemente aprobada por la OMS.
Esta historia comienza en la década de 1960, cuando una pareja de investigadores brasileños, Ruth (1928-2018) y Victor Nussenzweig, que trabajaban en la Universidad de Nueva York (NYU), en Estados Unidos, se dedicaron a estudiar el parásito causante de la malaria en África con el propósito de hallar la manera de activar anticuerpos sensibles a este en los organismos infectados.
El matrimonio centró sus observaciones en la fase de su desarrollo en la cual el parásito se asemeja a una espora (esporozoíto) y es inoculado en la sangre por el mosquito. Según Sergio Schenkman, del Laboratorio de Biología Molecular y Celular de Parásitos de la Universidad Federal de São Paulo (Unifesp), los Nussenzweig iniciaron los estudios con esporozoítos de P. falciparum construyendo un insectario para la cría de los mosquitos en los laboratorios de la NYU. “Ellos mantenían una colonia de mosquitos Anopheles y comenzaron a exponerlos a radiación. A continuación, los inducían a picar ratones”, describe el microbiólogo, quien escuchó estos relatos de la pareja cuando realizó una pasantía en el New York University Medical Center bajo la supervisión de Victor Nussenzweig, a finales de la década de 1980.
“Ruth Nussenzweig fue la primera investigadora que demostró, en un artículo publicado en la revista Nature, en 1967, que la inmunización con esporozoítos inactivados mediante rayos X era capaz de inducir una inmunidad protectora contra la infección en ratones”, subraya Irene da Silva Soares, del Departamento de Análisis Clínicos y Toxicológicos de la Facultad de Ciencias Farmacéuticas de la Universidad de São Paulo (FCF-USP). “Posteriormente, Ruth, Victor y sus colaboradores revelaron en un artículo en la revista Science, en 1984, cómo aislaron el gen que codifica a la proteína que reviste a los esporozoítos, denominada CSP”. Esta proteína, que activa la respuesta inmune contra el paludismo, constituye la base de la vacuna aprobada recientemente. “Es por ello que se puede considerar a ambos como ‘los padres’ de la vacuna contra la malaria. Desde mi punto de vista, han sido estudios dignos de un Premio Nobel”, declara la parasitóloga de la USP.

J R Ripper / Brazil Photos / Lightrocket vía Getty Images
El uso de mallas protectoras dificulta la transmisión del parásito del paludismo por el mosquito AnophelesJ R Ripper / Brazil Photos / Lightrocket vía Getty ImagesLa vacuna contra la malaria es la primera que ha podido desarrollarse para proteger a los seres humanos contra una infección causada por parásitos y se ha tardado décadas en hacerla viable a causa de diversas complicaciones. A efectos su comparación con otras enfermedades y vacunas más recientes y ampliamente debatidas, el P. falciparum posee más de 5.000 genes, mientras que el Sars-CoV-2, el virus que causa el covid-19, solamente tiene 12. “Los parásitos tienen un ciclo de vida complejo, que involucra varias fases morfológicas y cambios del ambiente en el cual se desarrollan en el interior del organismo humano. Además, han adoptado múltiples maneras de escapar del sistema inmunológico del hospedante. En el caso del paludismo, para los científicos es un gran reto hallar un blanco para el desarrollo de la vacuna, ya que el parásito exhibe un alto grado de polimorfismo genético”, explica Célia Regina da Silva Garcia, también de la FCF-USP.
Silvia Beatriz Boscardin, del Departamento de Parasitología del Instituto de Ciencias Biomédicas de la USP (ICB-USP), añade al razonamiento de su colega: “Más allá de tener un genoma mucho más complejo que el de los virus, los parásitos pueden reproducirse en hospedadores diferentes, tanto vertebrados como invertebrados, y presentan distintas formas de desarrollo. Estas formas normalmente expresan proteínas distintas”, dice. “Todo esto hace del desarrollo de una vacuna contra parásitos una tarea mucho más complicada”.
Aun frente a tamaño desafío, el grupo de investigación de Da Silva Soares ha venido desarrollando, desde 2008, con el apoyo de la FAPESP, una vacuna contra la variante de paludismo de mayor incidencia en Brasil, causada por P. vivax. El proyecto es un legado de un exalumno de Ruth Nussenzweig, el inmunólogo Maurício Martins Rodrigues, quien fue docente de la Unifesp y estaba casado con Da Silva Soares (Martins Rodrigues falleció en 2015). La fórmula también está basada en la CSP, que en P. vivax, exhibe una complejidad adicional: el parásito tiene tres variantes genéticamente distintas dispersas por todo el mundo. “Nuestra meta es el desarrollo de una vacuna universal, que cubra toda esta diversidad genética del P. vivax”, comenta Da Silva Soares.
Según la investigadora, hay grupos trabajando en Estados Unidos y en el Reino Unido en procura de obtener vacunas similares. Pero la de su grupo sería la única que busca inducir inmunidad protectora contra las tres variantes del parásito, según da cuenta un estudio publicado este año en la revista Scientific Reports. “Los test preclínicos ya han finalizado y han demostrado que la fórmula genera una respuesta inmunológica y no indujo efectos adversos significativos en ratones y conejos. En breve le enviaremos la documentación a la Anvisa y solicitaremos autorización para la realización de los ensayos clínicos de fase I en humanos”, dice la investigadora de la FCF-USP.
Otro horizonte que se abre para las vacunas antipalúdicas –en la actualidad, se están desarrollando más de 140 en todo el mundo– tiene que ver con los avances tecnológicos que ha promovido la pandemia de covid-19. Para Da Silva Soares, nuevas estrategias como las vacunas de ARNm y de vectores virales basados en adenovirus están generando un conocimiento que se aplicará para mejorar vacunas ya existentes o en fase de desarrollo. “Las estrategias de vacunación que utilizan una combinación de vacunas distintas ya vienen probándose en un modelo experimental de malaria desde la década de 1990 en el grupo que comandaba Ruth Nussenzweig”, ejemplifica Da Silva Soares. “Disponemos de adenovirus recombinantes basados en la proteína CSP de P. vivax, que podrían utilizarse, de ser necesario, para potenciar la respuesta inmunitaria de la vacuna que estamos desarrollando”.
Proyecto
Generación y análisis de la inmunogenicidad de las proteínas recombinantes basadas en las diferentes formas alélicas del antígeno circumsporozoíta de Plasmodium vivax con miras al desarrollo de una vacuna universal contra el paludismo (n° 12/13032-5): Modalidad Proyecto Temático; Investigadora responsable Irene da Silva Soares (USP); Inversión R$ 16.167.637,14
Artículos científicos
CHANDRAMOHAN, D. et al. Seasonal malaria vaccination with or without seasonal malaria chemoprevention. New England Journal of Medicine. 9 sept. 2021.
HOGAN, A.B. et al. Estimated impact of RTS,S/AS01 malaria vaccine allocation strategies in sub-Saharan Africa: A modelling study. PLOS Medicine. 30 nov. 2020.