Em um evento em setembro nos Estados Unidos, uma empresa norte-americana que domina o mercado mundial de sequenciadores anunciou uma nova máquina. Em sua versão top, o equipamento, que deve começar a ser entregue no próximo ano ao custo de quase US$ 1 milhão, promete triplicar a capacidade de leitura da molécula de DNA, o material genético das células, que armazena a receita de como são feitos e funcionam os seres vivos. Se apresentar o desempenho esperado, esse sequenciador será capaz de realizar a leitura do genoma de 20 mil pessoas por ano, cada um por cerca de US$ 200, segundo reportagem publicada no site da revista Wired. É uma redução de custo espantosa em apenas duas décadas. O primeiro rascunho do genoma humano, publicado em 2001, exigiu a cooperação de milhares de pessoas e o uso de centenas de máquinas em diferentes centros. Consumiu anos para definir a ordem dos 3 bilhões de pares de bases nitrogenadas (as unidades químicas que compõem o DNA) do genoma – usou o material genético de uns 50 indivíduos para consolidar o equivalente ao genoma de uma única pessoa. Segundo uma estimativa do Instituto Nacional de Pesquisa do Genoma Humano (NHGRI), dos Estados Unidos, que coordenou o esforço, só o sequenciamento consumiu algo entre US$ 500 milhões e US$ 1 bilhão – o projeto todo custou US$ 3 bilhões.
O avanço e o barateamento das técnicas de sequenciamento, associados à evolução das ferramentas de bioinformática, que permitem analisar grandes volumes de dados e comparar as características genéticas de números elevados de pessoas, estão aproximando os testes genéticos da prática clínica, ainda que de modo mais lento que o estimado pelos mais entusiastas há duas décadas, quando se imaginou que o sequenciamento do genoma humano aumentaria o poder dos médicos de tratar, prevenir e curar doenças. Hoje é possível realizar em centros especializados, inclusive no Brasil, uma diversidade desses testes, que analisam de partes de um gene específico a todo o genoma. Por causa do preço ainda elevado do genoma completo, até R$ 20 mil em laboratórios privados do país, os médicos solicitam com mais frequência o sequenciamento do exoma para procurar a causa de doenças com alta probabilidade de terem origem genética. Esse exame, que custa por volta de R$ 5 mil, permite identificar alterações de múltiplos genes ao analisar os trechos codificantes de proteínas dos mais de 20 mil genes humanos, que representam menos de 2% do genoma. No Brasil, os protocolos clínicos e diretrizes terapêuticas do Ministério da Saúde preveem que ele seja oferecido pelo Sistema Único de Saúde (SUS) para a investigação de deficiência intelectual de natureza indeterminada na infância. Mas isso ainda não ocorre.

Léo Ramos Chaves / Revista Pesquisa FAPESP Pesquisador insere cartão com material genético em sequenciador…Léo Ramos Chaves / Revista Pesquisa FAPESP
Até alguns anos atrás a investigação das doenças de origem genética buscava alterações em um gene por vez. Sequenciava-se o gene suspeito de estar associado a determinado problema e, quando não se encontravam mutações nele, partia-se para o seguinte. “Era um processo lento, trabalhoso e caro”, recorda o médico geneticista Roberto Giugliani, da Universidade Federal do Rio Grande do Sul (UFRGS). “As tecnologias de sequenciamento progrediram em escala exponencial a partir do projeto genoma humano, ampliando a capacidade de análise e reduzindo os custos”, afirma o pesquisador, que também lidera o setor de doenças raras da Dasa Genômica, um dos maiores centros privados de diagnóstico em genética no país.
Hoje as análises de um único gene continuam a ser feitas, mas em situações restritas, quando já se sabe qual alteração genética procurar. É o caso de algumas doenças raras, enfermidades que, individualmente, afetam frações muito pequenas da população, mas, em conjunto, atingem 6% da população mundial e uns 13 milhões de brasileiros. Elas são, na maioria das vezes, causadas por defeitos em um só gene (são doenças monogênicas). Testes mais abrangentes, que incluem a análise de milhares de genes ou de milhões de pontos no genoma (ou até seu sequenciamento completo) e poderiam ser de interesse de um número bem maior de pessoas, vêm sendo adotados na investigação de muitas doenças raras e estão ganhando espaço no portfólio de laboratórios e empresas privados, que nos últimos anos também passaram a oferecer, por algumas centenas de reais, exames vendidos diretamente ao consumidor.
Apelidados de testes recreativos, esses exames dispensam a exigência de um pedido médico e costumam comparar trechos do material genético do indivíduo com informações de bancos de dados internacionais. Alguns, os chamados testes de ancestralidade, permitem, por exemplo, conhecer a provável região geográfica de origem dos antepassados. Outros se propõem a identificar, a partir da informação dos genes, a dieta ou o tipo de atividade física mais adequada ou ainda a verificar a presença de versões de genes que poderiam predispor a uma série de doenças que atingem uma proporção elevada da população, como o diabetes tipo 2, os problemas cardiovasculares ou o câncer. “Esses testes genéticos diretos ao consumidor se tornaram o maior produto de genética para a população geral”, relata o geneticista Michel Naslavsky, professor da Universidade de São Paulo (USP) e pesquisador do Instituto Israelita de Ensino e Pesquisa Albert Einstein, que investiga alterações gênicas de risco para doenças.
A quantidade e o tipo de informação genética que os testes diretos ao consumidor analisam, porém, não dão diagnóstico nem estimativa precisa de risco para essas doenças ou prover orientações específicas sobre como preveni-las. Assim como as doenças monogênicas, as enfermidades mais comuns também têm uma componente genética relevante. Mas há uma diferença fundamental. Nas doenças comuns a componente depende da interação de centenas ou milhares de genes (são poligênicas), cada um deles contribuindo muito pouco para o efeito final. Por esse motivo, é necessário que ocorram alterações em um grande número desses genes para a doença se manifestar. Encontrar defeito em um ou um punhado deles não costuma significar nada – o mesmo vale para características complexas, como o desenvolvimento de força muscular , o acúmulo de gordura corporal ou a estatura –, uma vez que ainda existe a influência de fatores ambientais.
“Os testes vendidos diretamente ao consumidor usam dados genéticos que permitem mostrar curiosidades sobre o indivíduo, como sua ancestralidade, mas não são capazes de fornecer evidências que permitam orientar a conduta médica”, afirma a médica geneticista Rayana Maia, professora da Universidade Federal da Paraíba (UFPB) e diretora do Departamento de Ética da Sociedade Brasileira de Genética Médica e Genômica (SBGM). “Muitas das variantes genéticas [versões alteradas dos genes] identificadas nesses testes não estão associadas a risco relevante de doença. O resultado pode trazer mais angústia do que benefício”, conclui.

Léo Ramos Chaves / Revista Pesquisa FAPESP … e depois analisa o resultadoLéo Ramos Chaves / Revista Pesquisa FAPESP
Com potencial uso clínico ou apenas recreativo, o fato é que os testes genéticos representam um negócio bilionário, que, segundo algumas análises, cresce à taxa de quase 10% ao ano. Em um relatório divulgado meses atrás, a empresa norte-americana Straits Research, que realiza análises de mercado, estimou que esses testes tenham movimentado US$ 14,8 bilhões no mundo em 2021, valor que deve chegar a US$ 36 bilhões em 2030.
Diante de tanta oferta, surgem as dúvidas: quem deve fazer um teste genético? Quando?
A resposta é… depende. Se for para conhecer com um pouco mais de detalhe de onde vieram seus antepassados, não há problema. Pode-se fazer quando desejar. Mas é bom ter em mente que o resultado pode variar de acordo com a empresa que oferece o teste. Os dados genéticos da pessoa são confrontados com informações de dezenas de milhares de indivíduos armazenadas no banco de dados do fornecedor do teste. Em geral, esses bancos de dados são constituídos por informações de pessoas que vivem na Europa e nos Estados Unidos e têm ascendência majoritariamente caucasiana. “Um teste desses realizado com o material genético de um brasileiro, por exemplo, pode não identificar a existência de antepassados nativos da América do Sul ou de algumas regiões da África”, conta Maia.
Agora, se o objetivo for descobrir se há risco elevado de desenvolver alguma doença no futuro ou de transmitir para um filho uma alteração genética associada a uma enfermidade grave, a resposta muda. “O teste genético para diagnóstico só deve ser realizado com orientação médica e em uma situação de aconselhamento genético porque, se não houver uma indicação específica, o resultado pode trazer mais prejuízo do que benefício ao indivíduo”, afirma o médico geneticista José Cláudio Casali da Rocha, criador e coordenador do Centro de Oncogenética do A.C.Camargo
Cancer Center, em São Paulo. “A pessoa pode sofrer a vida toda com medo de desenvolver uma doença que pode nunca se manifestar”, explica.
O problema é fazer um teste, mesmo que recreativo, a fim de conhecer o próprio perfil genético e saber se suas células guardam versões (variantes) de genes que podem estar de alguma forma associadas a doenças. “Os testes genéticos, em seus diferentes tipos, são poderosas ferramentas de diagnóstico que, em geral, permitem encerrar uma longa busca pela origem de uma doença de causa desconhecida”, conta o endocrinologista Alexander Jorge, da USP, especializado em doenças genéticas. “Realizado sem uma indicação precisa, sem uma pergunta a ser respondida, pode revelar alterações que não têm significado clínico e levar a interpretações erradas.”
Na espécie humana, o genoma de um indivíduo é 99,9% idêntico ao de outro. Isso significa que, em quase sua totalidade, a sequência das quatro bases nitrogenadas – adenina (A), timina (T), citosina (C) e guanina (G) – no material genético de duas pessoas, gêmeas idênticas ou nascidas em regiões opostas do planeta, é a mesma. O que torna um ser humano diferente do outro é aquele 0,1%, que representa 3 milhões de pares dessas bases. “O número de variações no genoma de dois seres humanos saudáveis é grande, mas pouquíssimas têm uma influência já conhecida sobre a saúde e, muitas vezes, é difícil identificar qual ou quais delas estão associadas a um problema”, explica Giugliani, da UFRGS.
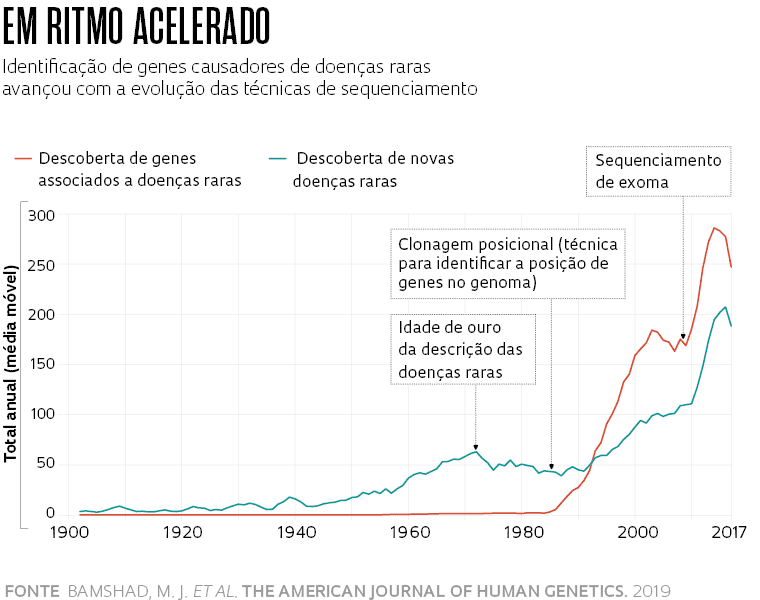
O progresso das técnicas de sequenciamento e análise gênica das últimas décadas aumentou drasticamente o número de genes e variantes conhecidos que desempenham algum papel em doenças. O avanço mais claro e significativo ocorreu no campo das monogênicas. Nelas, a alteração em um único gene tem um impacto devastador, suficiente para prejudicar de modo importante alguma função do organismo. Essas enfermidades costumam ser graves – algumas fatais, como a atrofia muscular espinal – e se manifestar já na infância.
Em um comentário publicado em 2019 na revista The American Journal of Human Genetics, o pediatra Michael Bamshad, da Universidade de Washington, nos Estados Unidos, e colaboradores relataram que a descrição dessas enfermidades e a identificação dos genes que as causavam só avançaram rapidamente a partir de meados dos anos 1980, com a evolução das técnicas de sequenciamento e o Projeto Genoma Humano (ver gráfico). Até então, apenas cerca de 40 genes haviam sido caracterizados como causadores de algumas delas. Até 21 de novembro, haviam sido mapeadas alterações em 4.721 genes associadas a 7.286 doenças raras, segundo a base Online Mendelian Inheritance in Man (Omim).
Nesses casos, os testes genéticos têm um papel importante para melhorar a identificação e, quando disponível, o tratamento precoce, além da prevenção, feita por meio de aconselhamento genético das famílias que têm a versão alterada do gene e planejam ter filhos. “Algumas doenças raras são muito difíceis de serem reconhecidas com base apenas no quadro clínico”, afirma Alexander Jorge, da USP. “Nesses casos, o sequenciamento do exoma encurta o tempo de diagnóstico, reduz custos e permite orientar a família.”
Identificar a causa das doenças genéticas melhora a qualidade de vida por permitir ao médico selecionar os remédios mais eficientes para atenuar os sintomas e evitar os medicamentos que os agravam. Também ajuda a preparar pais e cuidadores para a evolução da enfermidade. “Ainda não estão disponíveis terapias que permitam alterar os genes e curar essas doenças, mas, em muitas delas, é possível tratar os sintomas e oferecer uma qualidade de vida melhor para a criança”, afirma a geneticista Maria Rita Passos-Bueno, que, em parceria com a geneticista Mayana Zatz, coordena o Laboratório de Testes Genéticos (LabTEG) do Centro de Estudos do Genoma Humano e Células-tronco (CEGH-CEL) da USP.
Uma das áreas que mais vêm se beneficiando dos testes genéticos é a oncologia. Embora possam se manifestar com características diversas (evolução rápida ou lenta; potencial alto ou quase nulo de cura), os diferentes tipos de câncer conhecidos são doenças essencialmente genéticas. Alterações em um ou mais genes modificam a programação das células e as levam a se multiplicar descontroladamente, danificando os órgãos.
Nos últimos anos, os oncologistas começaram a usar diversos tipos de testes para rastrear no genoma alterações que sabidamente elevam a probabilidade de câncer e tentar reduzir o risco de desenvolver a doença. Também passaram a se valer de informações genéticas dos tumores para selecionar o medicamento e a dose mais adequados para cada indivíduo, ou ainda tratamentos a serem evitados. Consórcios internacionais e agências reguladoras de medicamentos como a FDA, dos Estados Unidos, já listam mais de 250 medicamentos (vários de uso oncológico) rotulados para serem prescritos com base no perfil genômico dos pacientes. “Os testes genéticos ajudam a definir quais vias bioquímicas o tumor está usando para crescer e a identificar medicamentos que podem inibir ou bloquear o funcionamento delas”, conta Casali, do A.C.Camargo.
Um desafio é obter formas de extrair do perfil genético informações para estimar o risco de doenças comuns
Anos atrás, estudando o perfil genético de 192 brasileiras com um tipo de câncer de mama que cresce sob a ação do hormônio feminino estrogênio, Casali e colaboradores constataram que nem todas respondiam como esperado ao tratamento com tamoxifeno. Esse composto inibe a produção de moléculas às quais o hormônio se liga na superfície das células tumorais, reduzindo a ação do estrogênio. Ele é administrado em uma versão inerte, que é ativada no fígado pela enzima CYP2D6. Mulheres com uma alteração nesse gene produzem uma versão menos funcional da enzima. Segundo o trabalho, publicado em 2020 na Clinical and Translational Science, essa característica explicou em parte por que nessas pessoas o nível do medicamento ativo no sangue era inferior ao necessário para evitar o retorno do câncer.
Em um ensaio clínico de fase 2, a equipe do oncologista Fabrice André, do centro especializado em câncer Gustave Roussy, em Paris, submeteu 238 mulheres com câncer de mama com metástase a dois tratamentos: 157 receberam medicamentos específicos para combater os efeitos das alterações genéticas características de seus tumores e 81 seguiram com a quimioterapia tradicional. Depois de quase dois anos de acompanhamento, o primeiro grupo havia conseguido conter a progressão da doença, em média, por nove meses, e o segundo por menos de três meses, de acordo com artigo publicado em julho na Nature.
Um desafio que permanece é obter formas de extrair do perfil genético informações confiáveis para estimar o risco de desenvolver doenças comuns, que atingem uma fatia importante da população, como as cardiovasculares ou o diabetes. Segundo estudos genéticos, na maioria dos casos, essas doenças são provocadas por alterações em um número grande de genes. Cada alteração contribui muito pouco para a enfermidade – nos casos mais expressivos, uma variante pode explicar 0,2% do risco de ter a doença –, mas os efeitos delas se somam.
Nos últimos anos, começou a ser testada na genética a ideia de se usar uma fórmula matemática – o escore de risco poligênico – para estimar a probabilidade de desenvolver essas doenças. De modo simplificado, esse escore, ou perfil de risco, consiste na soma do efeito de todas as variantes de risco do indivíduo, levando em consideração a contribuição de cada uma delas. Segundo um artigo de revisão publicado em 2018 na Nature Reviews Genetics pelo químico especialista em informática e genômica Ali Torkamani, do Instituto de Pesquisa Scripps, nos Estados Unidos, trabalhos recentes começam a demonstrar a utilidade desses escores para identificar grupos de indivíduos mais suscetíveis a desenvolver algumas dessas enfermidades e que poderiam se beneficiar de acompanhamento ou intervenções médicas.

Léo Ramos Chaves / Revista Pesquisa FAPESP Alguns testes genéticos perdem poder de predição em populações miscigenadas, como a brasileiraLéo Ramos Chaves / Revista Pesquisa FAPESP
No Centro de Medicina Genômica do Hospital Geral de Massachusetts, nos Estados Unidos, o grupo do cardiologista e geneticista Sekar Kathiresan desenvolveu anos atrás um escore de risco poligênico para obesidade baseado em informações de 2,1 milhões de variantes gênicas com influência conhecida sobre o índice de massa corporal (IMC). A ferramenta foi testada usando informações genéticas e de saúde de 300 mil pessoas. O escore permitiu quantificar o risco de vir a ter obesidade severa – ter IMC superior a 40 kg/m2; o saudável é entre 18 e 25 kg/m2 – e o aumento da probabilidade de desenvolver algumas doenças. Os 10% dos indivíduos com o maior número de variantes de risco eram 25 vezes mais propensos a se tornarem superobesos do que os 10% com menor número dessas alterações. No primeiro grupo, o risco de ter diabetes, sofrer tromboembolismo e desenvolver hipertensão foi, respectivamente, 70%, 40% e 35% mais elevado, segundo os resultados publicados em 2019 na revista Cell.
Apesar de promissores, os escores de risco poligênico ainda estão longe de chegar aos consultórios médicos. Antes, precisam ser validados em amostras grandes de populações de diferentes regiões do planeta. Sabe-se, por exemplo, que essas ferramentas, criadas com base em dados genéticos de grupos com ascendência majoritariamente europeia, perdem poder de predição em populações miscigenadas. Investigando o desempenho de um escore para predizer a altura das pessoas, uma característica de fácil aferição, a geneticista brasileira Bárbara Bitarello, que faz estágio de pós-doutorado na Universidade da Pensilvânia, nos Estados Unidos, constatou que o poder de predição da ferramenta diminuía de quatro a cinco vezes em grupos com ancestralidade africana, segundo estudo publicado em 2020 na Genes, Genomics, Genetics.
Nessas situações, a ancestralidade deixa de ser apenas uma curiosidade e passa a ter relevância médica. “Os trabalhos começam a mostrar que, para calcular o risco genético de desenvolver um problema de saúde, será importante levar em conta a ancestralidade”, afirma o geneticista Eduardo Tarazona Santos, da Universidade Federal de Minas Gerais (UFMG), que investiga a ancestralidade dos brasileiros. Ele explica que o efeito de algumas variantes gênicas pode mudar em função de terem sido herdadas de populações africanas, europeias ou ameríndias.
Um estudo liderado por Michel Naslavsky e Claudia Suemoto, da USP, e publicado em setembro na Molecular Psychiatry, do qual participou Tarazona, revelou que tanto a versão de um gene que aumenta o risco de ter Alzheimer quanto a que protege contra a doença apresentam em população de origem africana um efeito atenuado em relação à de origem europeia. “Por enquanto, os resultados dos escores de risco poligênico têm de ser avaliados com cautela. Mais de 2 mil escores já foram propostos, mas poucas dezenas foram validados em populações latino-americanas”, afirma Tarazona.
Projetos
1. CEGH-CEL – Centro de Estudos do Genoma Humano e de Células-tronco (nº 13/08028-1); Modalidade Centros de Pesquisa, Inovação e Difusão (Cepid); Pesquisadora responsável Mayana Zatz (USP); Investimento R$ 54.769.696,92.
2. INCT 2014 – Envelhecimento e doenças genéticas: Genômica e metagenômica (nº 14/50931-3); Modalidade Projeto Temático; Pesquisadora responsável Mayana Zatz (USP); Investimento R$ 2.913.294,82.
Artigos científicos
BAMSHAD, M. J. et al. Mendelian gene discovery: Fast and furious with no end in sight. The American Journal of Human Genetics. v. 105, p. 448-55. 5 set. 2019.
NARDIN, J. M. et al. The influences of adherence to tamoxifen and CYP2D6 pharmacogenetics on plasma concentrations of the active metabolite (z)-endoxifen in breast cancer. Clinical and Translational Science. v. 13, p. 284-92. 2020.
ANDRÉ, F. et al. Genomics to select treatment for patients with metastatic breast cancer. Nature. 3 jul. 2022.
TORKAMANI, A. et al. The personal and clinical utility of polygenic risk scores. Nature Reviews Genetics. v. 19, p. 581-90. set. 2018.
KHERA, A. V. et al. Polygenic prediction of weight and obesity trajectories from birth to adulthood. Cell. v. 177, p. 587-96. 18 abr. 2019
BITARELLO, B. D. e MATHIESON, I. Polygenic scores for height in admixed populations. Genes, Genomes, Genetics. nov. 2020.
NASLAVSKY, M. S. et al. Global and local ancestry modulate APOE association with Alzheimer’s neuropathology and cognitive outcomes in an admixed sample. Molecular Psychiatry. 7 set. 2022.