Novembro trouxe algum alento após quase um ano de pandemia e o início de uma segunda onda de casos de Covid-19 na Europa, nos Estados Unidos e possivelmente no Brasil. Em duas semanas, quatro das 11 empresas farmacêuticas e instituições de pesquisa com algum composto candidato a vacina em fase final de testes em seres humanos anunciaram seus resultados. Todas as formulações alcançaram índices de proteção contra o desenvolvimento da doença que, segundo a dose, variaram de 62% a 95%, superando os 50% inicialmente considerados aceitáveis pela Organização Mundial da Saúde (OMS) e por agências regulatórias de vários países para uma vacina capaz de ajudar a conter a propagação de um vírus que já matou quase 1,5 milhão de pessoas no mundo.
A possibilidade de chegar a uma vacina disponível para uso amplo foi seguida de manifestações de otimismo, que, no entanto, não afastaram dúvidas que só devem ser respondidas com o tempo e a continuidade dos estudos. Por ora, não se sabe quanto tempo dura a imunidade proporcionada por esses compostos nem se ela impede que as pessoas sejam infectadas pelo vírus ou apenas evita que adoeçam, algo já muito relevante. Também não há evidências de que possam funcionar em crianças ou gestantes, grupos ainda não incluídos nos testes de eficácia, nem há resultados definitivos sobre o desempenho em idosos e pessoas com doenças preexistentes. Falta também conhecer detalhes do escalonamento da produção e da distribuição a diferentes países. As duas formulações mais promissoras, a da Pfizer e a da Moderna, são vacinas gênicas e empregam uma tecnologia nova, nunca aplicada em larga escala em seres humanos. A primeira exige condições de armazenamento e distribuição difíceis de serem estruturadas rapidamente mesmo nos países desenvolvidos.
“Os números apresentados da eficácia desses compostos são bastante promissores, mas não se pode dizer muito mais”, pondera o imunologista Jorge Kalil, da Faculdade de Medicina da Universidade de São Paulo (FM-USP), que integra dois comitês internacionais de especialistas responsáveis pela análise preliminar de compostos candidatos a vacina. “Os dados ainda são muito gerais e os detalhes só devem ser conhecidos quando os resultados forem publicados na forma de artigo científico”, prossegue.
Cristiana Toscano, epidemiologista da Universidade Federal de Goiás (UFG) e membro do Grupo de Trabalho de Vacinas para Covid-19 da OMS, responsável por recomendar estratégias e políticas de vacinação contra o vírus, tem uma visão mais positiva. “Mesmo preliminares, os resultados são muito animadores e sugerem que as formulações protegerão contra a doença e a infecção”, afirma.
Em 20 de novembro, a farmacêutica norte-americana Pfizer, uma das maiores do mundo, deu um passo à frente das concorrentes e encaminhou à Food and Drug Administration (FDA), a autoridade regulatória dos Estados Unidos, o pedido para que sua formulação desenvolvida em parceria com a alemã BioNTech seja aprovada para uso emergencial. “Este é um dia histórico para a ciência”, declarou Albert Boula, diretor-executivo da Pfizer. “Levou apenas 248 dias desde o anúncio de nossos planos de colaborar com a BioNTech até a apresentação dos dados ao FDA.”
Nas três semanas seguintes, um batalhão de médicos, estatísticos e epidemiologistas da FDA deverão se debruçar sobre milhares de páginas com informações de 43 mil voluntários que participaram dos testes clínicos de fase 3 do composto BNT162b2, a última antes do possível registro e licenciamento do produto. Até 10 de dezembro, os técnicos da agência devem revisar também os planos de produção do composto.

Amanda Perobelli / Reuters / Fotoarena
Desembarque no aeroporto de Guarulhos, em São Paulo, do composto CoronaVac, desenvolvido pela farmacêutica chinesa Sinovac com o Instituto ButantanAmanda Perobelli / Reuters / FotoarenaSe tudo correr bem, o BNT162b2 pode se tornar a primeira das 212 formulações candidatas a vacina contra o novo coronavírus a atravessar todas as fases de avaliação em seres humanos e entrar em uso. Em agosto, em uma ação questionada por especialistas, a agência regulatória da Rússia já havia se antecipado e aprovado o uso no país do Sputnik V, imunizante criado pelo Centro Nacional de Pesquisa em Epidemiologia e Microbiologia N. F. Gamaleya e o Fundo de Investimento Direto Russo (RDIF), sem concluir todas as etapas de estudos em seres humanos necessárias para confirmar a eficácia do produto – os primeiros resultados de fase 3 só saíram em 24 de novembro e indicaram uma proteção de até 95%.
O composto da Pfizer-BioNTech também pode se tornar a primeira vacina gênica liberada para seres humanos. O BNT162b2 contém um trecho sintético da molécula de RNA-mensageiro do vírus com a informação química para fazer a proteína da espícula, que forma a coroa do Sars-CoV-2. Encapsulado em partículas de gordura que se fundem às células humanas, esse RNA induz a produção da proteína viral (ver Pesquisa FAPESP nº 293). Essa molécula é depois apresentada ao sistema imune, que a reconhece como estranha ao organismo e inicia a produção de anticorpos. A mesma estratégia foi adotada pela Moderna, pequena farmacêutica norte-americana que, em fins de novembro, concluía seus ensaios clínicos e previa apresentar ao FDA o pedido de avaliação para uso emergencial do imunizante mRNA-1273, desenvolvido com os Institutos Nacionais de Saúde (NIH) dos Estados Unidos.
As notícias encorajadoras começaram a surgir em meados do mês, quando Pfizer, Moderna e o Gamaleya divulgaram resultados preliminares dos estudos de fase 3. Os protocolos dos ensaios preveem que comitês de monitoramento de dados e segurança, formados por especialistas independentes e sem vínculo com as empresas, acessem os dados sigilosos do estudo, realizem a avaliação parcial de eficácia e segurança e repassem as conclusões gerais para os desenvolvedores do produto – os detalhes permanecem em segredo até o encerramento dos testes. Embora não sejam definitivas, as análises parciais permitem saber se os resultados justificam a solicitação de um registro preliminar ou autorização para uso emergencial do composto antes do término dos estudos, que, no caso atual, devem durar ao menos 12 meses. “Elas costumam ser realizadas em circunstâncias excepcionais quando os potenciais benefícios podem justificar o registro antecipado para uso emergencial de uma vacina”, explica Toscano, da UFG.
Nas análises preliminares, os comitês de especialistas tiveram acesso aos dados assim que uma quantidade predefinida de casos de Covid-19, estabelecida por cálculos estatísticos antes do início dos testes, foi alcançada. Ele corresponde ao número mínimo de eventos que precisam ocorrer para que o estudo estime com precisão adequada se a formulação reduziu o risco da doença no grupo tratado, quando comparado com o grupo de controle, que recebeu placebo (composto inócuo) ou vacina contra outra enfermidade. Na avaliação do composto da Pfizer-BioNTech, esse número foi de 170 casos da doença, mas houve estimativas anunciadas com base em 20 eventos.
O primeiro comunicado animador surgiu na segunda-feira, 9 de novembro. Naquela data, Pfizer e BioNTech anunciaram que seu composto havia evitado que mais de 90% das pessoas tratadas desenvolvessem Covid-19. A ele, seguiram-se outros quatro. No dia 11, o Centro Gamaleya e o RDIF informaram, com base na análise preliminar de apenas 20 casos de Covid-19, que o composto Sputnik V protegia da doença mais de 92% daqueles que o receberam – essa formulação usa um vírus do resfriado (adenovírus) alterado para não se reproduzir e introduz o gene da espícula do Sars-CoV-2 nas células humanas.
Cinco dias depois, a Moderna anunciou que a formulação mRNA-1273 evitou que 94,5% das pessoas tratadas desenvolvessem Covid-19 e que os dados permitiam supor que protegesse também os idosos, o grupo mais propenso a desenvolver quadros graves e morrer. Dois dias mais tarde, em 18 de novembro, a Pfizer surpreendeu ao informar que havia concluído os testes de fase 3 com os resultados melhores que os de antes: o BNT162b2 protegeu 95% das pessoas da Covid-19, esse índice foi de 94% entre aquelas com mais de 65 anos.
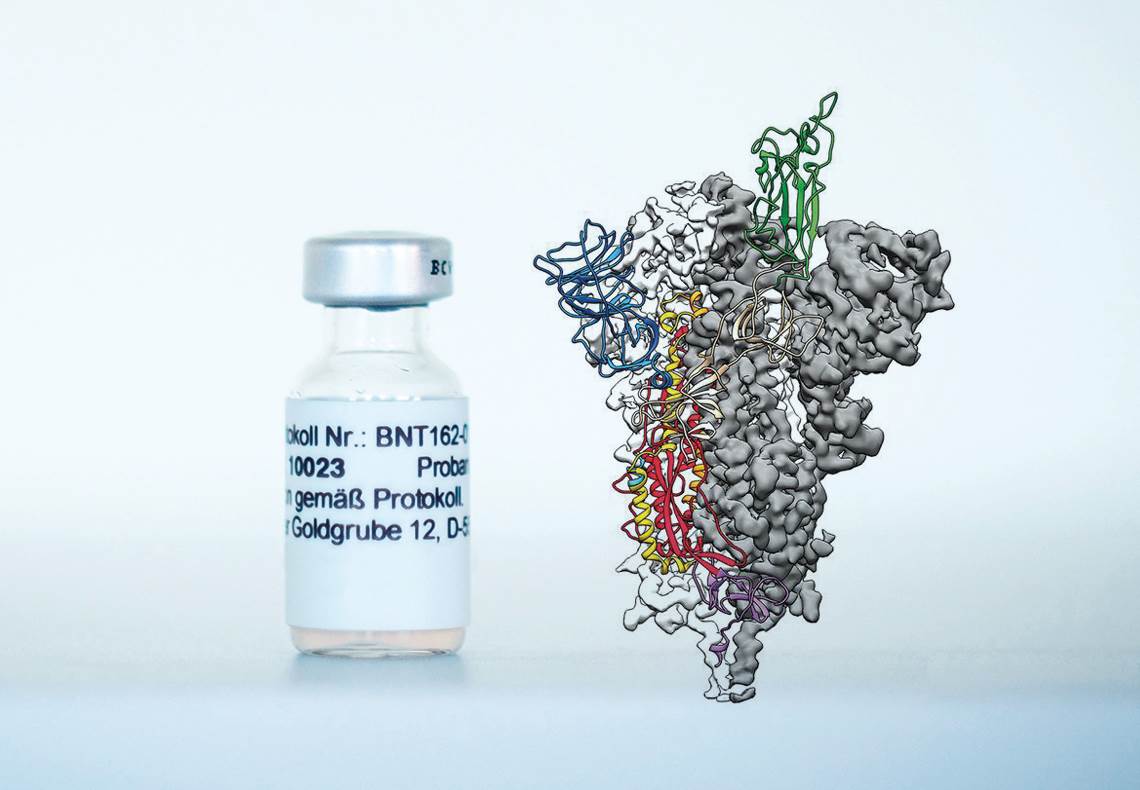
Biontech e WRAPP, D. et al. Science. 2020
A formulação BNT162b2, candidata a vacina do consórcio Pfizer-BioNTech, e imagem da proteína da espícula do coronavírus, contra a qual são produzidos os anticorposBiontech e WRAPP, D. et al. Science. 2020Antes que o mês terminasse, representantes da farmacêutica sueco-britânica AstraZeneca e da Universidade de Oxford, no Reino Unido, vieram a público em 23 de novembro informar que a formulação do grupo – a AZD1222, que usa um vetor viral (vírus inócuo) para transportar o gene da espícula do vírus para as células humanas – evitou o adoecimento de 62% das pessoas que receberam duas doses completas e protegeu 90% das pessoas tratadas com outro esquema (meia dose inicial e uma completa um mês mais tarde). O último resultado, soube-se mais tarde, foi obtido na avaliação de um grupo restrito de participantes, com idade inferior a 55 anos. Após críticas na forma como os dados foram coletados e apresentados, o presidente da AstraZeneca, Pascal Soriot, afirmou que um novo ensaio clínico seria realizado para avaliar os dois esquemas de administração. Ainda no dia 23, o governo do estado de São Paulo e o Instituto Butantan anunciaram que o ensaio clínico de fase 3 da CoronaVac, desenvolvida em parceria com a farmacêutica chinesa Sinovac, chegou ao fim e os resultados devem ser divulgados em dezembro.
“É preciso olhar para os dados de eficácia dessas formulações com cautela”, alerta o infectologista Julio Croda, da Universidade Federal de Mato Grosso do Sul (UFMS) e da Fundação Oswaldo Cruz (Fiocruz). Para ele, uma eficácia de 90% ou 95% é elevada, mas falta saber quanto dura. “Por ora, os resultados divulgados permitem saber que a imunidade gerada se mantém por alguns meses, o que pode fazer diferença em uma emergência de saúde pública como a atual. Só a continuidade dos estudos trará mais informações”, conta.
Também não se sabe como essas formulações agirão em idosos, que têm resposta imune mais fraca; em pessoas com doenças preexistentes, mais vulneráveis à ação do vírus; nem em crianças. O consórcio Oxford-AstraZeneca planeja iniciar em breve a avaliação nesse último grupo, que não deve ser incluído entre aqueles que receberão inicialmente uma vacina aprovada. Outra questão é saber se os compostos em teste evitam que as pessoas sejam infectadas pelo vírus ou se apenas impedem que, uma vez infectadas, desenvolvam a Covid-19. É uma diferença sutil, com impacto relevante em saúde pública. Um imunizante que evita o adoecimento protege quem o recebe. Já o composto que impede o contágio beneficia também quem não o toma, por interromper a transmissão. “No primeiro caso, a pessoa pode não adoecer, mas ser portadora assintomática e transmitir o vírus”, explica o epidemiologista Fredi Diaz Quijano, da Faculdade de Saúde Pública da USP. “Só com o bloqueio da transmissão é possível alcançar a imunidade coletiva”, conclui.
Enquanto buscam essas respostas, as farmacêuticas se preparam para o desafio de fornecer um número elevado de doses assim que sair a aprovação de uso. A Pfizer estima produzir 50 milhões de doses este ano e 1,3 bilhão em 2021, enquanto a Moderna teria capacidade de preparar 20 milhões agora e de 500 milhões a 1 bilhão no próximo ano – essas formulações são administradas em duas doses e atenderiam metade desse número. Por mais que a capacidade produtiva aumente, porém, não deve haver vacina para todos no início. “A imunização deverá ser escalonada”, adverte Cristiana Toscano, da UFG. O mais provável é que, seguindo a orientação da OMS, os primeiros grupos a serem imunizados sejam os de pessoas com alta exposição ao vírus (profissionais da saúde e socorristas), os idosos e as pessoas com doenças preexistentes.
“O Brasil está organizado para administrar vacinas, mas a inclusão de uma nova sempre gera desafios de logística”, lembra a epidemiologista Carla Domingues, que dirigiu o Programa Nacional de Imunizações brasileiro, um dos maiores do mundo, de 2011 a 2019. Uma formulação em especial, a da Pfizer-BioNTech, pode impor mais dificuldade: ela exige temperaturas baixíssimas (-70 graus Celsius) para armazenamento e transporte, o que torna difícil a administração fora dos grandes centros urbanos. Segundo Domingues, também será preciso aprimorar o sistema de farmacovigilância nacional para acompanhar possíveis eventos adversos graves e verificar se há nexo causal com a vacina ou apenas coincidência temporal.
Mesmo com uma vacina eficaz disponível para todos, não será possível abandonar o distanciamento social, o uso de máscaras e a higienização. As vacinas iniciais devem ser aplicadas em duas doses e só devem gerar proteção comunitária se a maioria das pessoas as tomarem. Além disso, o organismo requer semanas para desenvolver defesas eficientes contra o vírus e demora para vacinar toda a população. Vai levar tempo até que a vida volte ao antigo normal.
Republicar

