Luego de casi un año de pandemia y del comienzo de una segunda ola de casos de covid-19 en Europa, Estados Unidos y posiblemente también en Brasil, el mes de noviembre trajo algo alivio. En un lapso de dos semanas, cuatro de las 11 empresas farmacéuticas e institutos de investigación con algún compuesto de una posible vacuna en fase final de ensayos en humanos dieron a conocer sus resultados. Todas las fórmulas lograron algún índice de protección contra el desarrollo de la enfermedad, que, según las distintas dosis, variaron entre un 62 % y un 95 %, superando el 50 % inicialmente considerado aceptable por la Organización Mundial de la Salud (OMS) y por las agencias de regulación de diversos países para que una vacuna sea capaz de ayudar a detener la propagación de un virus que ya ha matado a casi un millón y medio de personas en todo el mundo.
La posibilidad de obtener una vacuna disponible para su uso generalizado fue seguida de manifestaciones de optimismo, las cuales, empero, no despejaron todas las dudas que solo podrán responderse con el paso del tiempo y la continuidad de los estudios. Por ahora, no se sabe cuánto tiempo dura la inmunidad que proporcionan esos compuestos, ni tampoco si impide que la gente se infecte con el virus o solamente evita que se enfermen, algo que desde ya, es muy importante. Tampoco hay evidencias de su funcionamiento en niños o en embarazadas, grupos que aún no han sido incluidos en los test de eficacia, ni se cuenta con resultados concluyentes sobre su desempeño en ancianos y en personas con enfermedades preexistentes. También restan conocerse detalles de la escala de producción y distribución en diversos países. Las dos formulaciones más prometedoras, las de las compañías farmacéuticas Pfizer y Moderna, son vacunas genéticas y se basan en una tecnología novedosa, nunca aplicada a gran escala en seres humanos. La primera requiere de condiciones de almacenamiento y distribución que son difíciles de estructurar rápidamente, incluso en los países desarrollados.
“Los valores de eficacia que presentaron esos compuestos son bastante prometedores, pero no puede decirse mucho más”, afirma el inmunólogo Jorge Kalil, de la Facultad de Medicina de la Universidad de São Paulo (FM-USP), quien forma parte de dos comités internacionales de expertos a cargo del análisis preliminar de los compuestos de posibles vacunas. “Los datos todavía no son exhaustivos y los pormenores solo se conocerán cuando se publiquen los resultados en artículos científicos”, añade.
– La incertidumbre sobre el regreso a las aulas
– Los detectives de la pandemia
– Bienvenidas voces
La epidemióloga Cristiana Toscano, de la Universidad Federal de Goiás (UFG) y miembro del Grupo de Trabajo en Vacunas para el Covid-19 de la OMS, responsable de recomendar estrategias y políticas de vacunación contra el virus, tiene una opinión más positiva. “Si bien son preliminares, los resultados son muy alentadores y sugieren que esos compuestos brindarán protección contra la enfermedad y la infección”, afirma.
El 20 de noviembre, la compañía farmacéutica estadounidense Pfizer, una de las mayores del mundo, dio un paso al frente sobre sus competidoras y cursó la solicitud ante la Food and Drug Administration (FDA), la autoridad regulatoria de Estados Unidos, para que su fórmula desarrollada en colaboración con la firma alemana BioNTech sea aprobada para su uso de emergencia. “Este es un día histórico para la ciencia”, declaró Albert Boula, director ejecutivo de Pfizer. “Desde el anuncio de nuestros planes de colaboración con BioNTech, hemos demorado tan solo 248 días hasta la presentación de los datos a la FDA”.
En las tres semanas posteriores, un batallón de médicos, estadísticos y epidemiólogos de la FDA deberán estudiar miles de páginas con información sobre 43 mil voluntarios que participaron en los ensayos clínicos de la fase III del compuesto denominado BNT162b2, la última antes del posible registro y licencia del producto. De aquí al 10 de diciembre, los técnicos de la agencia también evaluarán los planes de producción del compuesto.

Amanda Perobelli/Reuters/Fotoarena
Desembarque en el aeropuerto de Guarulhos, en São Paulo, del compuesto denominado CoronaVac, desarrollado por la compañía farmacéutica china Sinovac junto con el Instituto Butantan localAmanda Perobelli/Reuters/FotoarenaSi todo sale bien, el BNT162b2 podría convertirse en la primera de las 212 fórmulas de posibles vacunas contra el nuevo coronavirus que supere todas las fases de evaluación en humanos y comience a utilizarse. En el mes de agosto, en una acción que fue cuestionada por los expertos, la agencia regulatoria de Rusia se había anticipado y aprobado en ese país el uso de Sputnik V, el agente inmunizante creado por el Centro Nacional de Investigaciones en Epidemiología y Microbiología N. F. Gamaleya y el Fondo Ruso de Inversión Directa (RDIF), antes de haberse completado todas las etapas de estudio necesarias en seres humanos para confirmar la eficacia del producto, cuyos primeros resultados de la fase III recién salieron a la luz el 24 de noviembre e indicaron una protección de hasta un 95 %.
El fármaco de Pfizer-BioNTech también podría convertirse en la primera vacuna genética aprobada para su uso en humanos. El compuesto BNT162b2 contiene un tramo sintético de la molécula de ARN mensajero del virus con la información química para producir la proteína de la espícula, que constituye la corona del Sars-CoV-2. Este ARN, encapsulado en partículas de grasa que se fusionan con las células humanas, induce la producción de la proteína viral (lea en Pesquisa FAPESP, edición nº 293). Luego, el sistema inmunológico reconoce a esta molécula como extraña al organismo y comienza a producir anticuerpos. Esta misma estrategia fue la adoptada por Moderna, una pequeña empresa farmacéutica estadounidense que, a finales de noviembre, estaba concluyendo sus ensayos clínicos y estimaba presentarle a la FDA la solicitud de evaluación para el uso de emergencia del inmunizante mRNA-1273, desarrollado en conjunto con los Institutos Nacionales de Salud (NIH, por su sigla en inglés), de Estados Unidos.
Las noticias alentadoras comenzaron a aparecer a mediados de mes, cuando Pfizer, Moderna y el Instituto Gamaleya divulgaron los resultados preliminares de los estudios clínicos de la fase III. Los protocolos de los ensayos prevén facilitarles el acceso a los datos secretos del estudio a comités conformados por expertos independientes y sin vínculo con las empresas para que realicen el monitoreo de los datos y de la seguridad y una evaluación parcial de su eficacia y seguridad, y les transmitan sus conclusiones generales a los desarrolladores del producto. En tanto, los pormenores permanecen en secreto hasta la finalización de los ensayos. Aunque no sean definitivos, los análisis parciales permiten saber si los resultados justifican la solicitud de un registro preliminar o la autorización para el uso de emergencia del compuesto antes de la conclusión de los estudios que, en el caso actual, demorarán al menos 12 meses. “Suelen realizarse en circunstancias excepcionales, cuando los beneficios potenciales pueden justificar el registro anticipado de una vacuna para su uso en casos de emergencia”, explica Toscano, de la UFG.
En los análisis preliminares, los comités de especialistas tuvieron acceso a los datos tan pronto como se alcanzó una cifra predefinida de casos de covid-19, que se establece por medio de cálculos estadísticos efectuados antes de comienzo de los ensayos. Dicho número corresponde a la cantidad mínima de eventos que deben producirse para que el estudio pueda estimar con una precisión adecuada si la fórmula redujo el riesgo de la enfermedad en el grupo tratado, cuando se lo compara con el grupo de control al que se le suministró un placebo (un compuesto inocuo) o una vacuna contra otra enfermedad. En el caso de la evaluación del compuesto de Pfizer-BioNTech, esa cifra fue de 170 casos de la enfermedad, pero se anunciaron estimaciones basadas en 20 eventos.
El primer anuncio esperanzador llegó el lunes 9 de noviembre. Ese día, Pfizer y BioNTech informaron que su formulación había evitado que más del 90 % de las personas tratadas desarrollaran covid-19. Le siguieron otros cuatro. El miércoles 11, el Centro Gamaleya y el RDIF anunciaron, con base en el análisis preliminar de tan solo 20 casos de covid-19, que el compuesto Sputnik V brindó protección contra la enfermedad a más del 92 % de los inoculados. Esta fórmula utiliza un virus del resfriado común (un adenovirus) alterado para que no se reproduzca e incorpora el gen de la espícula del Sars-CoV-2 en las células humanas.
Cinco días después, Moderna anunció que su fórmula mRNA 1273 evitó que el 94,5 % de los individuos tratados desarrollen covid-19 y que los datos permiten suponer que también protegería a los ancianos, el grupo más propenso a desarrollar cuadros graves de la enfermedad y morir. Dos días más tarde, el 18 de noviembre, Pfizer sorprendió al informar que había concluido los ensayos clínicos de la fase III con mejores resultados que los preliminares: la formulación BNT162b2 protegió del covid-19 al 95 % de las personas tratadas, y registró un índice del 94 % de protección entre los mayores de 65 años.
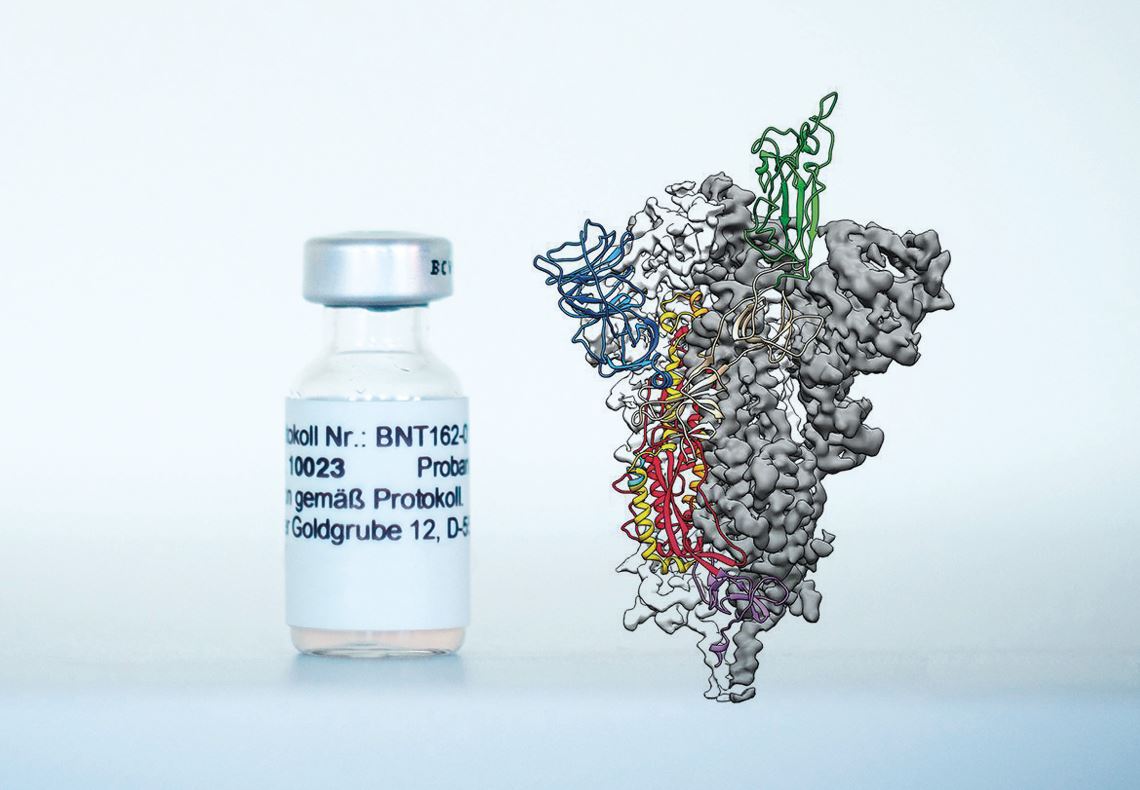
Biontech y Wrapp, D. et al. Science. 2020
La fórmula BNT162b2, candidata a vacuna del consorcio Pfizer-BioNTech, e imagen de la proteína de la espícula del coronavirus contra la cual se producen los anticuerposBiontech y Wrapp, D. et al. Science. 2020Antes de que terminara el mes, representantes de la empresa farmacéutica sueco-británica AstraZeneca y de la Universidad de Oxford, en el Reino Unido, hicieron público el día 23 que la fórmula desarrollada por el grupo –la AZD1222, que utiliza un vector viral (un virus inocuo) para introducir el gen de la espícula del virus en las células humanas– evitó que enfermara el 62 % de las personas inoculadas con dos dosis completas del preparado y protegió al 90 % de los individuos tratados con otro esquema (media dosis inicial y una completa un mes más tarde). Este último resultado, según pudo saberse más tarde, se obtuvo mediante la evaluación de un grupo acotado de participantes con edades inferiores a los 55 años. Al arreciar las críticas por la forma en que se recabaron y se presentaron los datos, el presidente de AstraZeneca, Pascal Soriot, declaró que se realizará un nuevo ensayo para evaluar los dos esquemas de administración del compuesto. También el día 23 de noviembre, el gobierno del estado de São Paulo y el Instituto Butantan anunciaron que el ensayo clínico de la fase III de CoronaVac, la vacuna desarrollada en colaboración con la empresa farmacéutica china Sinovac, había llegado a su fin y que los resultados serían divulgados en el mes de diciembre.
“Debemos ser prudentes con los datos de eficacia de estos compuestos”, advierte el infectólogo Julio Croda, de la Universidad Federal de Mato Grosso do Sul (UFMS) y de la Fundación Oswaldo Cruz (Fiocruz). En su opinión, una eficacia del 90 % o del 95 % es alta, pero hace falta saber cuánto dura. “Por ahora, los resultados divulgados permiten saber que la inmunidad generada se mantiene durante algunos meses, algo que puede marcar una diferencia en una emergencia de salud pública como la actual. Solo la continuidad de los estudios aportará más información”, comenta.
Tampoco se sabe cómo actuarán esas fórmulas en los ancianos, cuya respuesta inmunitaria es más débil, en las personas con enfermedades preexistentes, más vulnerables a la acción del virus, y en los niños. El consorcio Oxford-AstraZeneca tiene previsto iniciar pronto las pruebas con este último grupo, que no debe incluirse entre aquellos que recibirán inicialmente una vacuna aprobada. Otro tema pendiente reside en saber si los compuestos probados evitan que la gente se infecte con el virus, o bien si solamente impiden que, una vez infectados, desarrollen el covid-19. Es una diferencia sutil, pero tiene un gran impacto en la salud pública. Un inmunizante que evita enfermarse protege a quien lo recibe. En tanto, un compuesto que evita el contagio beneficia también a quien no es inoculado, porque interrumpe la transmisión. “En el primer caso, puede que el individuo en cuestión no se enferme, pero podría ser portador asintomático y transmitir el virus”, explica el epidemiólogo Fredi Diaz Quijano, de la Facultad de Salud Pública de la USP. “Solo mediante el bloqueo de la transmisión puede lograrse la inmunidad colectiva”, añade.
Mientras siguen buscando respuesta a esos interrogantes, las compañías farmacéuticas se aprestan a hacer frente al reto de proveer un alto número de dosis ni bien se apruebe su uso. Desde Pfizer estiman poder producir 50 millones de dosis en lo que resta de este año, y 1.300 millones en 2021, mientras que Moderna estaría en condiciones de elaborar 20 millones de dosis ahora y entre 500 y 1.000 millones durante el próximo año. Ambas fórmulas se administran en dos dosis y, por ello, cubrirían la mitad de esas cifras. Con todo, por mucho que aumente la capacidad de producción, en principio, las vacunas no estarían disponibles para todos. “La inmunización deberá realizarse en forma escalonada”, advierte Cristiana Toscano, de la UFG. Lo más probable es que, atendiendo a las sugerencias de la OMS, los primeros grupos inmunizados sean los correspondientes a aquellas personas con alta exposición al virus (los profesionales de la salud y los socorristas), los ancianos y las personas con enfermedades preexistentes.
“Los brasileños estamos organizados para el suministro de vacunas, pero la inclusión de una nueva siempre genera desafíos logísticos”, recuerda la epidemióloga Carla Domingues, quien dirigió el Programa Nacional de Inmunizaciones de Brasil, uno de los más amplios del mundo, entre 2011 y 2019. Una de las fórmulas en particular, la de Pfizer-BioNTech, puede acarrear dificultades mayores: la misma exige temperaturas sumamente bajas (-70 ºC) para su almacenamiento y transporte, lo que torna difícil su administración fuera de los grandes centros urbanos. Según Domingues, también será necesario mejorar el sistema nacional de control farmacológico para monitorear posibles efectos adversos graves y verificar si existe algún nexo causal con la vacuna o tan solo alguna coincidencia temporal.
Aun cuando exista una vacuna eficaz disponible para todos, no podrá prescindirse del distanciamiento social, del uso de mascarillas y de la higienización. Las vacunas iniciales se aplicarán bajo un esquema de dosis doble y solo generarán protección comunitaria si se inocula a la mayoría de las personas. Además, el organismo humano requiere semanas para desarrollar defensas efectivas contra el virus y, por otra parte, se tarda bastante para vacunar a toda la población. Va a pasar un tiempo hasta que la vida humana pueda volver a la antigua normalidad.
Republicar

