 Raul AguiarDos sensores desarrollados recientemente en Brasil pueden derivar en métodos de análisis clínicos y de diagnósticos de enfermedades más rápidos y más baratos. En la localidad paulista de São Carlos, un equipo de la Universidad de São Paulo (USP) perfeccionó un tipo de transductor químico, denominado sistema de detección conductimétrica sin contacto (C4D), que se volvió así 10 mil veces más sensible. Este avance lo torna equiparable con los mejores métodos existentes de realización de análisis clínicos o químicos en sistemas microfluídicos con empleo de microchips. En Río de Janeiro, científicos de la Pontificia Universidad Católica (PUC-Río), en colaboración con colegas de la Universidad Federal de Pernambuco (UFPE), crearon un sensor de fibra óptica destinado al diagnostico del dengue.
Raul AguiarDos sensores desarrollados recientemente en Brasil pueden derivar en métodos de análisis clínicos y de diagnósticos de enfermedades más rápidos y más baratos. En la localidad paulista de São Carlos, un equipo de la Universidad de São Paulo (USP) perfeccionó un tipo de transductor químico, denominado sistema de detección conductimétrica sin contacto (C4D), que se volvió así 10 mil veces más sensible. Este avance lo torna equiparable con los mejores métodos existentes de realización de análisis clínicos o químicos en sistemas microfluídicos con empleo de microchips. En Río de Janeiro, científicos de la Pontificia Universidad Católica (PUC-Río), en colaboración con colegas de la Universidad Federal de Pernambuco (UFPE), crearon un sensor de fibra óptica destinado al diagnostico del dengue.
El químico Renato Souza Lima, del Instituto de Química de São Carlos (IQSC) de la USP, y del Laboratorio Nacional de Nanotecnología (LNNano), dependiente del Centro Nacional de Investigación en Energía y Materiales, con sede en la ciudad de Campinas, sostiene que durante la última década, los dispositivos microfluídicos han sido bastante utilizados como herramienta analítica en diversas áreas, tales como la de análisis de metales pesados y la de control de calidad de bebidas y alimentos, y en aplicaciones biológicas en el área de medicina. Los microchips con el sistema C4D presentan otras ventajas, tales como la facilidad de miniaturización y su carácter universal como detectores. “Esto convierte a esta técnica en una alternativa ideal para una gama enorme de análisis químicos y bioquímicos”, dice Souza Lima.
Sin embargo, pese a sus ventajas, la técnica C4D presentaba una limitación importante cuando se la comparaba con las técnicas electroquímicas clásicas, tales como la amperometría y la voltametría: su baja sensibilidad. “Esos dos tipos de análisis son miles de veces más sensibles que la detección sin contacto (C4D)”, explica Emanuel Carrilho, docente del IQSC de la USP y director de tesis doctoral de Souza Lima. “Por eso, nuestro objetivo consistió en aumentar la eficiencia del dispositivo, mediante la expansión del área de cobertura de los electrodos (que se encargan de la detección de las sustancias sometidas a análisis) y la disminución del espesor del dieléctrico (el aislante eléctrico que los cubre). Es decir, lo que hicimos fue transformar el dispositivo de diagnóstico, que era poco sensible, en un sistema 10 mil veces más eficiente.”
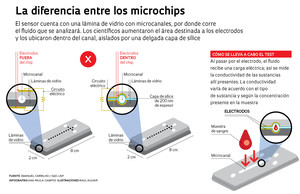 Ilustración: Raul AguiarPara arribar a este resultado, los científicos de São Carlos modificaron la arquitectura del aparato, cambiando de lugar los electrodos. Normalmente, los microchips con C4D están compuestos por una lámina de vidrio con microcanales, por los cuales corre el fluido que se pretende analizar, y otra plana, que hace las veces de “tapa”, en la cual se encuentran instalados dos electrodos. En esa configuración, éstos se ubican fuera de los microcanales, grabados en otra lámina de vidrio. De ese modo, la única forma de incrementar la sensibilidad del dispositivo sería agrandar el área de detección de los electrodos, lo cual resulta poco práctico. “Nuestra solución consistió en ponerlos dentro de los microcanales, como un anillo concéntrico”, comenta Carrilho. Para evitar que el electrodo entre en contacto con la sustancia que se analizará, que es una característica del detector C4D, se lo aísla aplicándole una cobertura fina, elaborada con una capa de 200 nanómetros de dióxido de silicio.
Ilustración: Raul AguiarPara arribar a este resultado, los científicos de São Carlos modificaron la arquitectura del aparato, cambiando de lugar los electrodos. Normalmente, los microchips con C4D están compuestos por una lámina de vidrio con microcanales, por los cuales corre el fluido que se pretende analizar, y otra plana, que hace las veces de “tapa”, en la cual se encuentran instalados dos electrodos. En esa configuración, éstos se ubican fuera de los microcanales, grabados en otra lámina de vidrio. De ese modo, la única forma de incrementar la sensibilidad del dispositivo sería agrandar el área de detección de los electrodos, lo cual resulta poco práctico. “Nuestra solución consistió en ponerlos dentro de los microcanales, como un anillo concéntrico”, comenta Carrilho. Para evitar que el electrodo entre en contacto con la sustancia que se analizará, que es una característica del detector C4D, se lo aísla aplicándole una cobertura fina, elaborada con una capa de 200 nanómetros de dióxido de silicio.
Para efectuar el análisis clínico de sangre u orina, por ejemplo, se induce a que una gota del material pase por los canales, donde el electrodo detecta la presencia de las sustancias de interés, ya sean endógenas, tales como glucosa o ácido úrico, por ejemplo, o exógenas, tales como fármacos o contaminantes. Esto se hace de manera indirecta, pues el sensor (el microchip) mide la conductividad eléctrica de la muestra del microfluido. “Esta conductividad varía de sustancia en sustancia y de concentración en concentración para una misma sustancia”, explica Carrilho. “Puede detectarse cualquiera que altere la conductividad de la solución al ocupar el canal.”
La óptica en el dengue
El sensor que desarrollaron los equipos de la PUC-Río y del UFPE, por su parte, se basa en la resonancia de plasmones superficiales localizados (LSPR, por sus siglas en inglés), un fenómeno óptico que sucede cuando la luz interactúa con nanopartículas metálicas, e induce una excitación colectiva de electrones. La LSPR permite que determinadas longitudes de onda (colores) puedan absorberse. La física Isabel Cristina Carvalho, responsable del Laboratorio de Optoelectrónica del Departamento de Física de la PUC-Río y una de las coordinadoras del trabajo, explica que el dispositivo está montado con una delgada película de oro de 6 nanómetros de espesor depositada en la punta de una fibra óptica que después se calienta durante cuatro minutos a 600ºC, lo que la transforma en nanopartículas de oro.
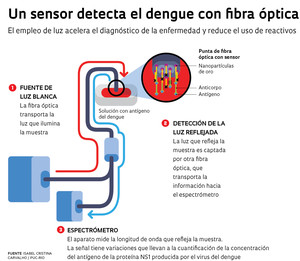 Ilustración: Raul Aguiar“En una punta de la fibra, sobre las nanopartículas de oro, se fija el anticuerpo NS1 de la proteína del mismo nombre excretado por el virus”, dice Rosa Dutra, docente de la PUC-Río. “La otra punta se conecta con un acoplador, del cual salen otras dos fibras ópticas, una que se conectará con una fuente de luz blanca y la otra con un espectrómetro que detecta la señal que se refleja en la punta de la fibra que contiene las nanopartículas y los anticuerpos anti-NS1”, dice Isabel. En el test, si la solución no contiene el antígeno, la longitud de onda medida con el espectrómetro no sufre alteraciones. De lo contrario, la señal medida experimentará variaciones de color, lo que determinará las diferentes concentraciones del antígeno NS1.
Ilustración: Raul Aguiar“En una punta de la fibra, sobre las nanopartículas de oro, se fija el anticuerpo NS1 de la proteína del mismo nombre excretado por el virus”, dice Rosa Dutra, docente de la PUC-Río. “La otra punta se conecta con un acoplador, del cual salen otras dos fibras ópticas, una que se conectará con una fuente de luz blanca y la otra con un espectrómetro que detecta la señal que se refleja en la punta de la fibra que contiene las nanopartículas y los anticuerpos anti-NS1”, dice Isabel. En el test, si la solución no contiene el antígeno, la longitud de onda medida con el espectrómetro no sufre alteraciones. De lo contrario, la señal medida experimentará variaciones de color, lo que determinará las diferentes concentraciones del antígeno NS1.
Alexandre Camara, alumno de doctorado de Carvalho, explica cómo funciona ese conjunto. “El efecto LSPR producido por las nanopartículas inmovilizadas con anticuerpos anti-NS1 en la punta de la fibra óptica recibe el influjo del ambiente externo, es decir, de la presencia o la ausencia de antígeno NS1. La respuesta del sensor depende en gran medida de ese ambiente exterior, y cualquier cambio de ese factor lleva a que el color absorbido por el medio cambie y se modifique la señal monitoreada. “No detectamos directamente el virus del dengue, sino una proteína (NS1) que excreta el virus. En una fase aguda de la enfermedad, el valor de esa proteína aumenta, lo que constituye un indicador precoz de la gravedad de la afección.”
La física Paula Gouvêa, del Laboratorio de Sensores de Fibra Óptica (LSFO) de la PUC-Río y también una de las líderes del trabajo, comenta que el sensor de dengue tuvo origen en otro que su grupo creara anteriormente. “Éste es una adaptación del que empezamos a desarrollar en 2007”, recuerda. “En aquella época, iniciamos una colaboración entre el LSFO, el Laboratorio de Optoelectrónica y el Instituto Real de Tecnología de Suecia, con miras a desarrollar un sensor de fibra óptica utilizando nanopartículas de oro”. En 2011, Renato Araújo, de la UFPE, asistió a una presentación de Gouvêa sobre el dispositivo y tuvo la idea de adaptarlo para detectar el dengue.
Así empezó, en 2012, la colaboración entre los grupos de la PUC-Río y de la UFPE. “Esto tuvo su inicio con el trabajo experimental realizado por los alumnos Alexandre Camara y Ana Carolina Dias”, comenta Gouvêa. En esa etapa de adaptación del sensor para la detección del dengue, el trabajo se desarrolló en ambas universidades. “Alexandre aprendió la técnica en la UFPE, en Recife, y la trajo a Río”. Hasta ahora, los ensayos se han realizado únicamente en soluciones producidas en laboratorio con los antígenos del dengue. El paso siguiente consistirá en la realización de mediciones in vivo, con muestras de sangre de pacientes infectados. “Lo que hemos hecho hasta ahora consiste en una prueba de concepto del nuevo sensor: todavía no es un prototipo”, explica Araújo. “Al igual que el nuestro, existen algunos otros métodos probados en laboratorio que podrían utilizarse en el diagnóstico del dengue. La transformación de un resultado como el que obtuvimos en un producto requiere todavía la ejecución de varios pasos, tales como la evaluación económica de la producción de las diferentes técnicas.”
Sin síntomas
De acuerdo con los resultados obtenidos en los ensayos, el nuevo dispositivo se mostró sumamente prometedor. Una de sus mayores ventajas consiste en permitir la detección del dengue desde el primer día de contaminación, cuando el paciente aún no presenta síntomas de la enfermedad. Esto resulta sumamente útil, ya que un diagnóstico precoz puede evitar la muerte de pacientes por no haber recibido el tratamiento adecuado a tiempo para prevenir problemas más graves, como los causados por el dengue hemorrágico. “Otra ventaja de nuestro sensor radica en que con él es posible realizar las mediciones con tan sólo una gota de muestra”, añade Camara. “El poco tiempo necesario para realizar el test (en 20 minutos es posible contar con un diagnóstico) y el esperado bajo costo de producción, también lo vuelven atractivo”. Rosa Dutra recuerda que este sensor puede ser portátil y puede usarse también en laboratorios.
Este trabajo fue financiado mediante una asociación entre la Coordinación de Perfeccionamiento del Personal de Nivel Superior (Capes) y la Swedish Foundation for International Cooperation in Researchand Higher Education, que apoya estudios conjuntos entre Brasil y Suecia. La investigación también contó con recursos de ambas universidades, del Consejo Nacional de Desarrollo Científico y Tecnológico (CNPq) y de la Fundación de Apoyo a la Investigación Científica del Estado de Río de Janeiro (Faperj). Un artículo referente al mismo salió publicado en la revista Optics Express.
El sensor químico para la realización de análisis clínicos que desarrolló el equipo de la USP de São Carlos tampoco está listo aún. “Ya ha generado una patente, pero todavía falta desarrollo”, dice Carrilho. “Se encuentra a punto como para salir de la universidad rumbo a una empresa de base tecnológica, para luego salir mercado. Una empresa de São Carlos llamada ParteCurae Analysis manifestó interés en la transferencia de tecnología”. Según Carrilho, existen tan sólo dos pequeños fabricantes de microchip con C4D en el mercado, por eso las mejoras que los investigadores desarrollaron en este tipo de sensor podrían volverlo más competitivo. La investigación contó con el apoyo de la FAPESP, mediante la asignación de una beca doctoral a Lima, y de la Financiadora de Estudios y Proyectos (Finep); y redundó en la publicación de un artículo en la revista ChemComm, de la Royal Society of Chemistry.
Proyecto
Sistemas microfluídicos electroquímicos ultrasensibles (nº 2010/ 08559-9); Modalidad Beca doctoral; Investigador responsable Emanuel Carrilho – IQ-USP; Becario Renato Souza Lima; Inversión R$ 88.808,87 (FAPESP).
Artículos científicos
Lima, R.S. et al. Highly sensitive contactless conductivity microchips based on concentric electrodes for flow analysis. Chemical Communications. Publicado online el 9 oct. 2013.
Camara, A.R. et al. Dengue immunoassay with an LSPR fiber optic sensor. Optics Express. v. 21, n. 22, p. 27023-31. nov. 2013.