La fiebre de chikunguña es una enfermedad altamente incapacitante causada por un virus que se transmite a través de las picaduras de los mosquitos hembra del género Aedes. Provoca fiebre alta, manchas rojas en el cuerpo y, principalmente, una inflamación y un dolor intenso en las articulaciones que pueden durar meses, obligando a las personas afectadas a caminar o mantenerse encorvadas. Sin embargo, se habla poco del riesgo de muerte, que es bajo, pero existe y, en ciertas regiones, incluso puede ser superior al promedio brasileño de muertes por dengue, que es de un caso por cada mil enfermos.
Desde su aparición en Brasil, en 2014, se ha comprobado que el virus del chikunguña ha infectado a 254.000 personas ‒ los casos sospechosos de la enfermedad ascienden a 1.200.000 ‒ y ha matado al menos a 909. El estado más afectado en estos 10 años es Ceará, que concentró el 31 % de los fallecidos. “Sabemos que el chikunguña puede matar, pero siempre quedaba la duda: ¿por qué mueren esas personas?”, indaga el virólogo brasileño William Marciel de Souza, de la Universidad de Kentucky, en Estados Unidos.
Para resolver el misterio, Marciel de Souza e investigadores de diversas instituciones de Brasil, Estados Unidos y el Reino Unido analizaron muestras de sangre y diversos tejidos de 32 personas que murieron como consecuencia de una infección aguda causada por el chikunguña en 2017 en Ceará. La información recabada fue comparada posteriormente con la de 39 individuos que desarrollaron formas más benignas de la enfermedad y sobrevivieron y con las de otros 15 donantes de sangre sanos. Los resultados de la investigación, financiada por la FAPESP, se publicaron en abril en la revista Cell Host & Microbe. La conclusión indica que el chikunguña mata porque el virus, conocido por las siglas CHIKV, se propaga por diversos tejidos, incluido el cerebral, y causa una inflamación severa que daña los órganos, impidiéndoles funcionar correctamente.
Al examinar las muestras, los investigadores constataron que, en general, los fallecidos presentaban una mayor concentración de sangre y una acumulación de líquido en los pulmones, el corazón, el hígado, el bazo, los riñones y el cerebro, aunque no tenían una mayor concentración de virus que los sobrevivientes ni estaban infectados por una variedad de CHIKV más agresiva.
La sangre de las personas que murieron también contenía niveles sustancialmente más altos de dos grupos de mensajeros químicos que los de los otros grupos: las citoquinas proinflamatorias, proteínas que coordinan las defensas, y las quimiocinas, un tipo de citoquinas que se encargan de atraer a las células del sistema inmunológico hacia los focos de inflamación. Estas moléculas, asociadas a un cuadro de hiperinflamación, alteran la permeabilidad de la pared interna de los vasos sanguíneos, permitiendo que la parte líquida de la sangre escape hacia el interior de los tejidos. También facilitan la penetración de las células de defensa en los tejidos que, al intentar eliminar al virus, a veces pueden destruir células sanas.
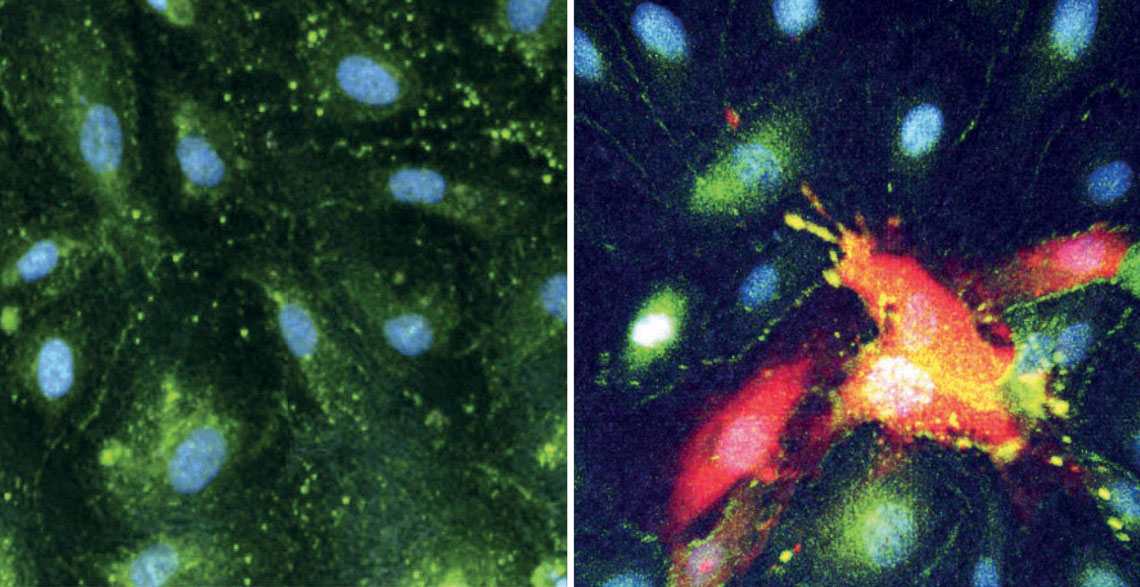
De souza, w. m. cell host & microbe. 2024 Células del revestimiento de los vasos sanguíneos del cerebro intactas (à izq.) e infectadas por el CHIKV y destruidasDe souza, w. m. cell host & microbe. 2024
Entre los muertos, se observó la presencia de células de defensa en el corazón, el hígado, los riñones y, lo que más intrigó a los investigadores, en el cerebro. Los vasos que irrigan el sistema nervioso central poseen un revestimiento especial y altamente selectivo denominado barrera hematoencefálica. Ésta permite el paso del oxígeno, de nutrientes y de algunas pocas células de defensa de la sangre hacia el cerebro, pero suele impedir el ingreso de patógenos. Marciel de Souza y sus colaboradores notaron que en todas las víctimas fatales el virus se encontraba en el líquido cefalorraquídeo, el fluido que baña el cerebro y los demás órganos del sistema nervioso central, lo que indica que el CHIKV había atravesado la barrera hematoencefálica. El virus se detectó en el 13 % de las muestras de cerebro, en el 20 % de las de corazón y los riñones, en el 28 % de las de hígado, en el 44 % de las de los pulmones y en el 52 % de las del bazo de las personas fallecidas.
Todos los infectados presentaban una desregulación metabólica, más intensa en los que murieron que en los sobrevivientes. Esta disfunción afectó la integridad y la permeabilidad de la barrera hematoencefálica, lo que puede haber facilitado la invasión de los agentes patógenos en el cerebro.
Sin embargo, este no fue el único ardid utilizado por el virus. Las pruebas de laboratorio efectuadas por el grupo revelaron que también fue capaz de infectar a los monocitos, células de defensa que normalmente atraviesan la barrera, utilizándolos como una especie de caballo de Troya. “El virus se esconde en el interior de los monocitos y así llega al cerebro”, explica la farmacéutica Shirlene de Lima, del Laboratorio Central de Salud Pública del Estado de Ceará (Lacen/CE), una de las autoras principales del estudio.
Al analizar los distintos órganos y tejidos afectados, los investigadores identificaron daños cuantiosos en el cerebro, con hemorragias y muerte celular. Aún no saben cuál de los factores ‒ el desequilibrio hemodinámico, la inflamación exacerbada o la infección del sistema nervioso central ‒ es el más importante para definir el desenlace fatal. “Debemos realizar más estudios para entender la contribución de cada uno de estos problemas y por qué afectan más a algunas personas que a otras”, dice De Lima. “Este conocimiento es fundamental para poder desarrollar mejores estrategias de tratamiento”. Actualmente, la terapia consiste en la administración de analgésicos, antitérmicos y antiinflamatorios para aliviar los síntomas.
“Este estudio aporta información relevante, especialmente sobre el comportamiento de las quimiocinas y las firmas moleculares asociadas a los pacientes que murieron”, dice el infectólogo Julio Croda, de la Fundación Oswaldo Cruz en Mato Grosso do Sul (Fiocruz-MS), quien no participó en la investigación. “La infiltración de monocitos infectados en el cerebro y su efecto constituye una novedad. Ahora necesitamos llevar a cabo estudios más amplios, con pacientes de diferentes etnias, edades y sexos para poder validar estas conclusiones”.
Hasta que se encuentre un tratamiento más eficaz, la esperanza está puesta en la llegada de una vacuna. En noviembre de 2023, la agencia que regula los alimentos y los medicamentos en Estados Unidos ‒ Food and Drug Administration (FDA) ‒ aprobó el uso en adultos del Ixchiq, un inmunógeno basado en el virus debilitado desarrollado por la empresa farmacéutica franco-austríaca Valneva. En Brasil, la compañía mantiene una colaboración con el Instituto Butantan, que actualmente está probando el compuesto en ensayos clínicos de fase III en adolescentes antes de presentar la solicitud de su aprobación ante la Agencia Nacional de Vigilancia Sanitaria (Anvisa).
Proyectos
1. Abordajes multiómicos para el estudio de la enfermedad del chikunguña (nº 19/24251-9); Modalidad Beca de Pasantía de Investigación en el Exterior – Posdoctorado; Investigador responsable Luiz Tadeu Moraes Figueiredo (USP); Becario William Marciel de Souza; Inversión R$ 301.943,10.
2. Caracterización, genómica y diagnóstico de virus con importancia para la salud pública en Brasil mediante secuenciación de alto rendimiento (nº 17/13981-0); Modalidad Beca posdoctoral; Investigador responsable Luiz Tadeu Moraes Figueiredo (USP); Becario William Marciel de Souza; Inversión R$ 303.193,93.
Artículo científico
DE SOUZA, W. M. et al. Pathophysiology of chikungunya virus infection associated with fatal outcomes. Cell Host & Microbe. abr. 2024.
