Un artículo publicado en enero en la revista Nature Medicine presentó cinco casos humanos de una forma potencialmente nueva ‒ y muy rara ‒ de la enfermedad de Alzheimer, adquirida a través de procedimientos médicos (iatrogénica), algo que ocurriría en situaciones excepcionales.
Los cinco pacientes llegaron entre 2017 y 2022 a un servicio especializado del sistema sanitario británico, derivados por otros hospitales. Presentaban los síntomas típicos de la enfermedad, tales como fallos de memoria recurrentes, dificultades en la organización del habla o la planificación de rutinas. Dos de ellos ya habían recibido previamente el diagnóstico clínico del alzhéimer, basado en marcadores de análisis hematológicos o de imágenes, y un tercer caso fue confirmado en la autopsia, que detectó las lesiones características de la enfermedad en el cerebro.
Los pacientes, que eran más jóvenes que lo habitual, fueron atendidos por el equipo del neurólogo John Collinge, de la University College London (UCL), coordinador del estudio. Tenían entre 38 y 55 años cuando empezaron a mostrar los síntomas, mientras que la forma esporádica ‒ responsable de casi el 99 % de los casos ‒ suele manifestarse predominantemente a partir de los 65 años. Además, no presentaban las mutaciones genéticas asociadas al alzhéimer hereditario, correspondiente a alrededor del 1 % de los casos de la enfermedad, ni tenían padres con estas alteraciones.
No obstante, todos tenían algo en común: en la infancia habían recibido inyecciones intramusculares de la hormona del crecimiento extraída de la hipófisis de cadáveres para tratar sus problemas de baja estatura. Esta versión de la hormona dejó de utilizarse en todo el mundo en 1985, y fue sustituida por la hormona sintética, tras la aparición de evidencias de que provocaba el desarrollo de una enfermedad neurológica fatal: la enfermedad de Creutzfeldt-Jakob, causada por una proteína infecciosa llamada prion.
En la UCL, Collinge dirige el Departamento de Enfermedades Neurodegenerativas y en el sistema sanitario británico, la Clínica Nacional del Prion, especializada en el diagnóstico y seguimiento de personas con enfermedades causadas por este agente infeccioso. Los priones son versiones defectuosas de una proteína abundante en la superficie de las neuronas e importante para el funcionamiento de estas células, responsables del procesamiento de la información en el cerebro. Pueden surgir espontáneamente o adquirirse a través de la ingesta de carne vacuna infectada o mediante el uso de instrumental de neurocirugía o implantes de tejidos que contengan priones (lea en Pesquisa FAPESP, edición nº 148). En el sistema nervioso central, inducen la deformación de las proteínas sanas, que se vuelven tóxicas y matan a las neuronas, dejando al cerebro poroso como si fuera una esponja.
“Nuestros hallazgos sugieren que el alzhéimer y algunas otras enfermedades neurológicas comparten mecanismos de evolución similares a los de la enfermedad de Creutzfeldt-Jakob”, dijo Collinge en un comunicado a la prensa.
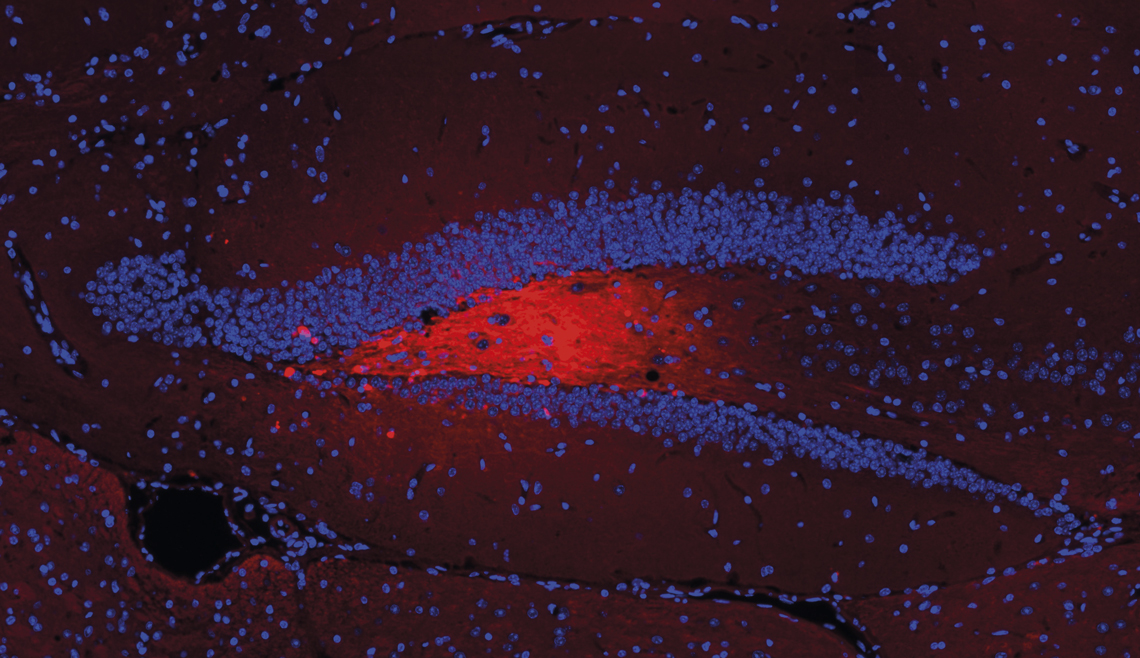
Victor Bodart Santos / UFRJLa imagen muestra las vesículas (rojas) con proteína beta-amiloide inyectadas en el hipocampo (la franja azul en forma de V) de ratonesVictor Bodart Santos / UFRJ
La enfermedad de Alzheimer, la forma de demencia más común en todo el mundo y responsable de hasta un 70 % de los casos, comienza con la acumulación de fragmentos de una proteína presente en la superficie de las neuronas, la proteína precursora amiloide. A medida que el organismo envejece, empieza a procesar esta proteína en forma anómala y la descompone en fragmentos denominados péptidos beta-amiloides, que tienden a agruparse. Debido a un incremento de su producción o por deficiencias en la eliminación de estos péptidos, comienzan a acumularse formando placas en el exterior de las neuronas que desencadenan eventos nocivos y, con el tiempo, causan que las proteínas tau en estado hiperfosforilado se agrupen en lo que se conoce como enmarañados u ovillos tóxicos. Estos, a su vez, matan a esas células y provocan los síntomas clínicos de la enfermedad. En los últimos años se ha descubierto que los péptidos beta-amiloides y las proteínas tau hiperfosforiladas pueden propagarse entre las neuronas mediante un proceso similar al de los priones.
Hacía al menos una década que Collinge y sus colaboradores sospechaban que, al igual que los priones, los péptidos beta-amiloides podían transmitirse de una persona a otra, iniciando la “siembra” de la enfermedad. Las primeras evidencias surgieron cuando la neuropatóloga Zane Jaunmuktane, de la UCL, identificó una acumulación de conglomerados de beta-amiloides en el cerebro y en los vasos sanguíneos del sistema nervioso central de cuatro pacientes que desarrollaron la enfermedad de Creutzfeldt-Jakob tras haber sido tratados con hormonas contaminadas con priones. Sin embargo, los resultados publicados en 2015 en la revista Nature, no permitían saber si las placas de beta-amiloides se encontraban allí antes que los priones o si habían sido “sembradas” con ellos.
La sospecha de una transmisión cobró fuerza en 2018. La química Silvia Purro, del equipo de la UCL, analizó los viales con los lotes de la hormona aplicados a los pacientes con Creutzfeldt-Jakob y constató que, además de los priones, contenían proteínas beta-amiloides y tau hiperfosforilada. Purro inoculó muestras contaminadas en el cerebro de ratones y demostró, en otro artículo también publicado en Nature, que ellas “sembraban” los péptidos y causaban las lesiones del alzhéimer. Entonces hacía falta encontrar las pruebas de que esto mismo podría haber ocurrido con las personas que habían recibido la hormona en la infancia.
La confirmación llegó con el artículo publicado en Nature Medicine. Parte de los pacientes con alzhéimer había recibido hormonas de lotes que contenían beta-amiloides y tau, incluso de los lotes que “sembraron” la enfermedad en roedores. “Descubrimos que la transmisión de la patología beta-amiloide es posible y contribuye al desarrollo de la enfermedad de Alzheimer”, dijo la neuróloga Gargi Banerjee, autora principal del estudio, en el comunicado de prensa.
“Sin embargo, se trata de un mecanismo poco frecuente. La transmisión se produjo por una vía muy específica. No es un agente contagioso, que pueda pasar de una persona a otra, por ejemplo, por contacto o intercambio de fluidos”, dice el neurólogo Adalberto Studart Neto, miembro del Grupo de Neurología Cognitiva y Conductual de la Facultad de Medicina de la Universidad de São Paulo (FM-USP), quien no participó en la investigación. De las 1.848 personas tratadas en el Reino Unido con la hormona del crecimiento procedente de donantes cadavéricos entre 1959 y 1985, solo cinco (el 0,3 %) habrían sido contaminadas con el péptido y desarrollaron alzhéimer.
En un comentario publicado en el mismo número de Nature Medicine, el neurocientífico suizo Mathias Jucker, de la Universidad de Tubinga (Alemania), y su colega estadounidense Lary Walker, de la Universidad Emory (EE. UU.), se mostraron cautos. “Por un lado, la prudencia indica que hay que tomar a estas conclusiones con cierta dosis de escepticismo. Los casos presentados son diversos y complicados; los pacientes habían sido sometidos a múltiples intervenciones médicas por diversos trastornos en etapas tempranas de la vida y resulta difícil excluir cualquier contribución de estas circunstancias a los complejos fenotipos de la enfermedad que aparecieron muchos años después”, escribieron. “Por otro lado”, señalaron, “hay buenas razones para tomarse en serio las conclusiones. Solo los individuos que recibieron hormona de crecimiento cadavérico preparada de una forma específica desarrollaron las características de la enfermedad de Alzheimer”.
Casi en simultáneo al surgimiento de los indicios de transmisibilidad de estos componentes, se acumularon evidencias, algunas obtenidas por brasileños, de la importancia de un mecanismo de propagación de estas enfermedades en el cerebro: la producción de vesículas extracelulares, pequeñas bolsas (del tamaño de un virus) que contienen proteínas, material genético e incluso orgánulos.
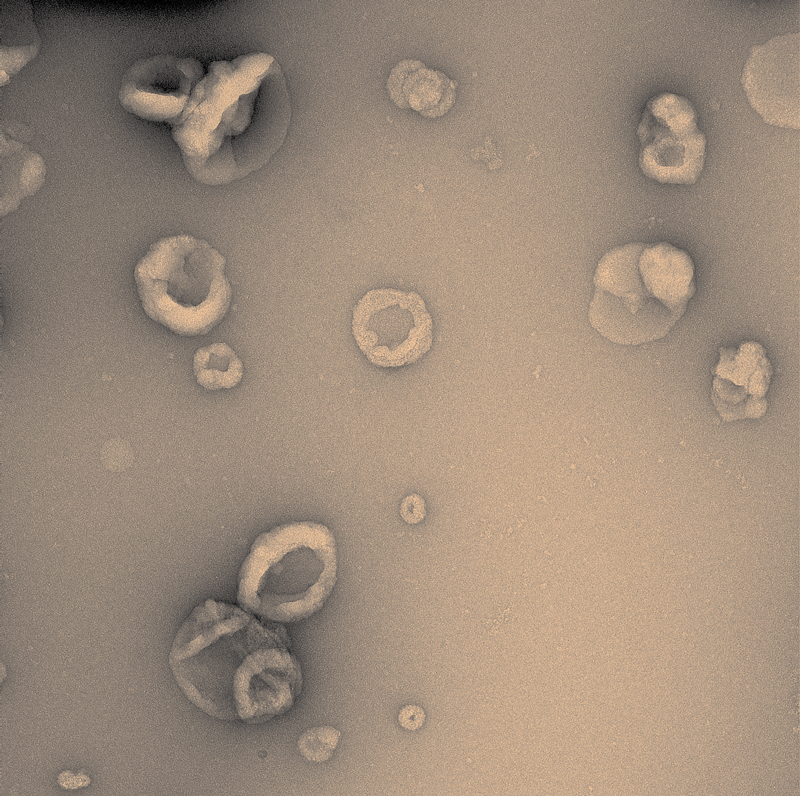
Victor Bodart Santos / UFRJDel tamaño de un virus, las vesículas contienen proteínas y contribuyen a la dispersión de las lesiones del alzhéimerVictor Bodart Santos / UFRJ
“Durante mucho tiempo se las consideró el camión recolector de basura de las células, que servía para eliminar lo que ya no servía más”, comenta la bioquímica y neurocientífica Fernanda De Felice, de la Universidad Federal de Río de Janeiro (UFRJ), quien estudia el papel de estas estructuras en el alzhéimer.
La percepción de que estos pequeños sacos podían desempeñar otras funciones empezó a modificarse cuando se constató que, en ciertas circunstancias, podían actuar como mensajeros celulares, además de contribuir a la propagación de las lesiones del alzhéimer. En un artículo publicado en 2012 en la revista Journal of Biological Chemistry, el grupo de la neurocientífica Efrat Levy, de la Universidad de Nueva York (EE. UU.), aisló vesículas producidas en el cerebro de los roedores utilizados en el estudio del alzhéimer y demostró que estas podían transportar copias del péptido beta-amiloide.
Posteriormente, según un artículo publicado en la revista Alzheimer’s & Dementia por el neurocientífico Tsuneya Ikezu y su equipo de la Universidad de Boston, se comprobó que las vesículas obtenidas del cerebro de las personas con alzhéimer contenían mucha más proteína beta-amiloide y tau hiperfosforilada que las de los individuos sanos. En otro estudio, publicado en 2021 en la revista Brain, el mismo grupo de Boston constató que las vesículas que contenían tau podían diseminar las lesiones del alzhéimer en el cerebro de roedores.
“En estas situaciones, funcionan como un caballo de Troya”, comenta el neurocientífico brasileño Victor Bodart Santos, quien realiza una pasantía posdoctoral en el laboratorio de Ikezu en la Clínica Mayo, en Estados Unidos.
En un estudio publicado en 2023 en Alzheimer’s & Dementia como parte de su doctorado realizado bajo la dirección de Felice, Bodart Santos comprobó que, además de propagar las lesiones, las vesículas cargadas con beta-amiloide y tau inducen los síntomas clínicos de la enfermedad.
Para ello, inyectó las vesículas con estos componentes en el cerebro de ratones y los sometió a una serie de pruebas. En los test para evaluar la motivación para explorar el ambiente, la capacidad de localizar un refugio y reconocer objetos, el desempeño de estos animales fue mucho peor que el de los que recibieron vesículas sin beta-amiloide ni tau. Los daños fueron más severos y se suscitaron más pronto cuando los roedores fueron genéticamente alterados para presentar la versión humana de la proteína tau.
“Aunque las vesículas no son vistas como el mecanismo principal de la dispersión de la enfermedad en el cerebro, este trabajo confirma que, por sí solas, pueden ser capaces de causar alzhéimer”, comenta el neurólogo Wyllians Borelli, coordinador de las investigaciones en el Centro de la Memoria del Hospital Moinhos de Vento, de Porto Alegre, Rio Grande do Sul.
“Las vesículas parecen constituir una forma eficiente de diseminar los componentes de la enfermedad en el cerebro porque los protegen del deterioro que podrían sufrir en el medio extracelular”, dice Bodart Santos. “No solo fueron capaces de propagar las lesiones sino de hacer que los animales manifiesten los comportamientos típicos de la enfermedad”, recuerda De Felice.
Artículos científicos
BANERJEE, G. et al. Iatrogenic Alzheimer’s disease in recipients of cadaveric pituitary-derived growth hormone. Nature Medicine. 29 ene. 2024.
JAUNMUKTANE, Z. et al. Evidence for human transmission of amyloid-β pathology and cerebral amyloid angiopathy. Nature. 10 sep. 2015.
PURRO, S. A. et al. Transmission of amyloid-β protein pathology from cadaveric pituitary growth hormone. Nature. 13 dic. 2018.
JUCKER, M. y WALKER, L. C. Evidence for iatrogenic transmission of Alzheimer’s disease. Nature Medicine. 29 ene. 2024.
JAUNMUKTANE, Z. et al. Evidence of amyloid-β cerebral amyloid angiopathy transmission through neurosurgery. Acta Neuropathologica. 15 feb. 2018.
PEREZ-GONZALES, R. et al. The exosome secretory pathway transports amyloid precursor protein carboxyl-terminal fragments from the cell into the brain extracellular space. Journal of Biological Chemistry. dic. 2012.
MURAOKA, S. et al. Proteomic and biological profiling of extracellular vesicles from Alzheimer’s disease human brain tissues. Alzheimer’s & Dementia. 17 abr. 2020.
RUAN, Z. et al. Alzheimer’s disease brain-derived extracellular vesicles spread tau pathology in interneurons. Brain. 12 feb. 2021.
BODART-SANTOS, V. et al. Alzheimer’s disease brain-derived extracellular vesicles reveal altered synapse-related proteome and induce cognitive impairment in mice. Alzheimer’s & Dementia. 19 may. 2023.