 CYNTHIA GOLDSMITH/CDCEl inmunólogo brasileño Michel Nussenzweig, de la Universidad Rockefeller, de Nueva York, parece hacer hallado la respuesta a una pregunta que todo el mundo le viene haciendo a los científicos y los propios investigadores se hacen dicha pregunta durante los últimos años: casi tres décadas después del descubrimiento del Sida, ¿por qué todavía no se arribado a una vacuna capaz de detener con eficiencia al virus que la provoca, el VIH? La explicación para ello es que las decenas de fórmulas de posibles vacunas probadas hasta el momento se elaboraron con base en una estrategia válida contra algunos virus, como el causante de la hepatitis B, pero no contra el VIH, que año tras año infecta todavía a alrededor de tres millones de personas en el mundo.
CYNTHIA GOLDSMITH/CDCEl inmunólogo brasileño Michel Nussenzweig, de la Universidad Rockefeller, de Nueva York, parece hacer hallado la respuesta a una pregunta que todo el mundo le viene haciendo a los científicos y los propios investigadores se hacen dicha pregunta durante los últimos años: casi tres décadas después del descubrimiento del Sida, ¿por qué todavía no se arribado a una vacuna capaz de detener con eficiencia al virus que la provoca, el VIH? La explicación para ello es que las decenas de fórmulas de posibles vacunas probadas hasta el momento se elaboraron con base en una estrategia válida contra algunos virus, como el causante de la hepatitis B, pero no contra el VIH, que año tras año infecta todavía a alrededor de tres millones de personas en el mundo.
Se esperaba aniquilar al VIH como los cazadores de lobisones eliminaban a los hombres lobo en las películas de terror: disparándoles una bala de plata en el corazón. En el caso del VIH, la bala sería una proteína (un anticuerpo) capaz de adherirse a un punto vital del virus e impedirle su ingreso en las células de defensa del organismo y su multiplicación. Cuatro de esos superanticuerpos han sido identificados, pero ninguno ha sido capaz aisladamente de detener al virus. Y es posible que ni siquiera producidos conjuntamente lo logren, toda vez que el VIH se comporta como un virus camaleón, que acumula pequeñas alteraciones a medida que se reproduce, tornando inútil la producción de anticuerpos contra él.
Ante los resultados desalentadores de esta estrategia, Nussenzweig y su equipo resolvieron intentar algo diferente. Investigaron de qué manera el organismo de un grupo especial de personas que producen una amplia gama de anticuerpos contra el VIH corresponden a alrededor del 10% de los portadores del virus combate naturalmente la infección. Al analizar la sangre de seis de esos portadores especiales, el grupo de la Rockefeller descubrió que sus organismos adoptan una estrategia de combate distinta: en vez de producir sólo uno o dos tipos de superanticuerpos contra el VIH, fabrican concentraciones elevadas de decenas de anticuerpos distintos que se adhieren a puntos distintos del virus, según informaron los investigadores en un artículo publicado en la edición del 2 de abril de la revista Nature.
Estos pacientes producen niveles elevados de anticuerpos distintos que individualmente tienen poco poder de neutralización, pero juntos son muy potentes?, explica Nussenzweig. De este modo, los controladores de élite mantienen al virus en concentraciones bajísimas en la sangre ?inferiores a 50 copias por mililitro a punto tal de evitar el surgimiento de los síntomas del Sida. Quienes desarrollan la enfermedad en general poseen millones de copias de VIH por mililitro de sangre.
 GABRIEL VICTORA E TANJA SCHWICKERT/UNIVERSIDADE ROCKEFELLERAunque los inmunólogos sabían de la existencia de los controladores de élite desde hacía algunos años, poco sabían sobre cómo los cuerpos enfrentaban la infección. Sucede que no era posible aislar las células de defensa de la sangre productoras de anticuerpos: los linfocitos B, capaces de conservar durante meses o años la receta de las proteínas que neutralizan la acción de microorganismos invasores.
GABRIEL VICTORA E TANJA SCHWICKERT/UNIVERSIDADE ROCKEFELLERAunque los inmunólogos sabían de la existencia de los controladores de élite desde hacía algunos años, poco sabían sobre cómo los cuerpos enfrentaban la infección. Sucede que no era posible aislar las células de defensa de la sangre productoras de anticuerpos: los linfocitos B, capaces de conservar durante meses o años la receta de las proteínas que neutralizan la acción de microorganismos invasores.
Esta situación solamente cambió recientemente, con el trabajo del inmunólogo alemán Johannes Scheid. Investigador visitante del laboratorio de Nussenzweig y primer autor del artículo de Nature, Scheid concibió una forma de aislar a los linfocitos B de la sangre de los portadores del virus. Con la ayuda de investigadores de Alemania y de otras instituciones de Estados Unidos entre ellos, David Ho, uno de los precursores en el uso del coctel de medicamentos contra el virus, recolectó centenas de linfocitos B de la sangre de seis personas que producían elevados niveles de anticuerpos contra el VIH. En total se identificaron 502 anticuerpos distintos, de los cuales 433 se conectaban a diferentes puntos de una proteína de la cápsula del virus (la gp140) empleada para adherirse a las células del sistema de defensa.
Mediante técnicas genéticas, Scheid y Nussenzweig reprodujeron los anticuerpos y los aplicaron en laboratorio contra el virus. Constataron que, por separado, ninguna de esas 433 proteínas tenía el poder de fuego de uno de los cuatro superanticuerpos conocidos. Pero reunidas en una especie de coctel que contiene de 20 a 50 variedades, exhiben una acción más amplia que la de los superanticuerpos. La base molecular de esta actividad aún no se ha determinado, pero puede ser producto de la combinación de los efectos aditivos de los diferentes anticuerpos, escribieron los autores del estudio.
Los investigadores no excluyen la posibilidad de que en el futuro se encuentre un superanticuerpo apto para detener el virus, pero creen que el ataque múltiple es más viable. Con base en estos resultados, comenta Nussenzweig, parece más prometedor intentar producir una vacuna con una acción más global que simule lo que sucede en el organismo de los individuos que combaten el virus naturalmente.
Pero nada de esto estará disponible para la gente en un futuro próximo. Pese al avance que este descubrimiento representa, todavía serán necesarios años de investigación hasta que se llegue una vacuna con propiedades similares a las del sistema inmunológico de quienes controlan bien al virus. Antes habrá que despejar una serie de dudas no se sabe, por ejemplo, cuál es la proporción de cada anticuerpo que sería necesaria para neutralizar al VIH, ni contra qué cepas del virus esta mezcla de anticuerpos puede ser eficiente. Sin embargo, Nussenzweig, no se desanima y apuesta a una nueva forma de producción de inmunizantes investigada en los últimos años: la concepción inteligente de vacunas (intelligent vaccine design, en inglés), que se vale de informaciones genéticas para estimular la producción de defensas más eficaces contra virus, bacterias y otros parásitos, además de células tumorales. La concepción inteligente de vacunas es la forma de pensar vacunas en el siglo XXI, comenta el inmunólogo que nació en Brasil pero vive en Estados Unidos desde hace casi cuatro décadas.
 CYNTHIA GOLDSMITH/CDCEl éxito de esta nueva estrategia dependerá de la habilidad para controlar la actividad de otro tipo de células del sistema inmunológico las células dendríticas, que activan la cadena de eventos celulares que culmina en la producción de anticuerpos, cuyo ciclo evolutivo ha sido dilucidado por el equipo de Nussenzweig en un artículo que mereció la tapa de la edición del 17 de abril de la revista Science, ilustrada con una imagen obtenida por el inmunólogo brasileño Gabriel Victora. Llamadas dendríticas porque exhiben prolongamientos que se asemejan a las ramas de un árbol (déndron, en griego), estas células funcionan como centinelas del cuerpo.
CYNTHIA GOLDSMITH/CDCEl éxito de esta nueva estrategia dependerá de la habilidad para controlar la actividad de otro tipo de células del sistema inmunológico las células dendríticas, que activan la cadena de eventos celulares que culmina en la producción de anticuerpos, cuyo ciclo evolutivo ha sido dilucidado por el equipo de Nussenzweig en un artículo que mereció la tapa de la edición del 17 de abril de la revista Science, ilustrada con una imagen obtenida por el inmunólogo brasileño Gabriel Victora. Llamadas dendríticas porque exhiben prolongamientos que se asemejan a las ramas de un árbol (déndron, en griego), estas células funcionan como centinelas del cuerpo.
Tan pronto como se deparan con virus, bacterias o incluso células tumorales (que perdieron las características que permiten su identificación como parte del propio organismo), las células dendríticas emiten prolongaciones similares a los brazos de un pulpo y los envuelven, los engullen y los destruyen. Luego de ese mecanismo de destrucción conocido como fagocitosis, las células dendríticas exponen en su propia superficie pedazos del invasor y se los presentan a otro grupo de células de defensa, los linfocitos T, que a su vez accionan a los linfocitos B, productores de anticuerpos.
Las células dendríticas maduras, listas para inducir la producción de anticuerpos, se encuentran en órganos que integran el sistema inmunológico como el bazo y los linfonodos. También están presentes en la piel y en las membranas que revisten los órganos en contacto directo o indirecto con el ambiente, como la nariz, los pulmones y los intestinos. Pero desde hace casi cuatro décadas se intentaba descubrir qué células del sistema de defensa las originaban.
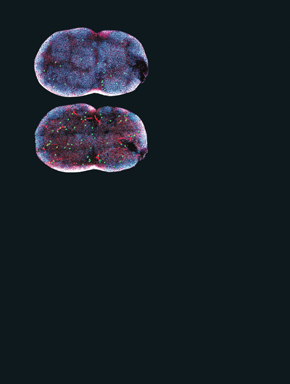
En el laboratorio de Nussenzweig, la investigadora Kang Liu tuvo la idea de usar proteínas encontradas exclusivamente en las células dendríticas maduras para identificar a sus precursoras. De la medula ósea de lauchas, aisló posibles genitoras de las células dendríticas marcadas con una proteína verde fluorescente y se las inyectó a roedores genéticamente idénticos. Con la ayuda de una técnica avanzada que permite ver células del sistema inmunológico en actividad en el cuerpo de animales vivos la microscopía intravital multifotones, Kang Liu, Victora y Tanja Schwickert siguieron el trayecto de estas células en el cuerpo de las lauchas y documentaron sus estadios de desarrollo.
El equipo de la Rockefeller confirmó que las células dendríticas efectivamente surgen en el interior de los huesos, al igual que las demás células del sistema de defensa, y aún estando inmaduras, llegan a la corriente sanguínea y se esparcen por el cuerpo. En parte se alojan en el bazo y en los linfonodos, donde maduran hasta que más o menos una semana más tarde están listas para detectar invasores.
A diferencia de lo que muchos inmunólogos creían, las células dendríticas evolucionan a partir de genitores distintos que los que generan macrófagos, otro grupo de células de defensa especializadas en realizar la fagocitosis, pero menos aptas para desencadenar respuestas inmunes. Éstas son descendientes directas de los monocitos, mientras que las primeras son generadas por células a las que el equipo de Nussenzweig designó con el nombre de precursores de células dendríticas (pre-CD’s).
El conocimiento acerca del origen preciso de estas células y todos los pasos de su desarrollo es fundamental para que se sepa cómo puede manipulárselas con miras a obtener vacunas, explica Victora. La identificación de los órganos en que se desarrollan y se alojan ayudará a comprender las funciones que ejecutan, añade Nussenzweig. Los investigadores imaginan que la respuesta inmune generada depende del nivel de desarrollo en que las células dendríticas se despiertan por acción de los patógenos invasores.
Se cree también que es posible generar una respuesta inmunológica más eficiente al suministrarles directamente a las células dendríticas moléculas que ellas reconozcan como pertenecientes a microorganismos invasores. La forma tradicional de producción de vacunas se basa en la inyección de grandes fragmentos o formas inactivas de virus o bacterias, de los cuales solamente una parte llega a las células dendríticas y activa la producción de una variedad restringida de anticuerpos. La idea del grupo de Nussenzweig es desarrollar técnicas que permitan direccionar cantidades mucho más bajas de proteínas víricas al tipo de célula dendrítica necesario para desencadenar la respuesta inmune adecuada contra el VIH una estrategia cuyo uso cabrá también en otras afecciones. Con base en este principio, Michel Nussenzweig trabaja en sociedad con sus padres, Ruth y Victor, inmunólogos de renombre mundial que actúan en la Universidad de Nueva York, en el desarrollo de una posible vacuna contra la malaria, producida con base en la estimulación de las células dendríticas.
No obstante, tanto la producción de vacunas con base en la estimulación de células dendríticas como la creación de una nueva tanda de inmunizantes contra el VIH, son promesas que, para concretarse, pasarán años. Al fin y al cabo, como recuerda Michel Nussenzweig, sólo recientemente su equipo logró desarrollar as herramientas necesarias como para aislar linfocitos B y seguir de cerca el desarrollo de las células dendríticas en animales vivos. Cuatro o cinco años atrás, dice el investigador, este trabajo hubiese sido imposible.
Artículos científicos
SCHEID, J. F. et al. Broad diversity of neutralizing antibodies isolated from memory B cells in HIV-infected individuals. Nature. v. 458, p. 636-640. 2 abr. 2009.
LIU, K.; VICTORA, G. et al. In vivo analysis of dendritic cell development and homeostasis. Science. v. 324, p. 392-397. 17 abr. 2009.