Los síntomas principales del paludismo ‒ fiebre, cansancio, malestar y dolores corporales ‒ suelen aparecer entre 10 y 15 días después de que el parásito causante de la enfermedad, el protozoo del género Plasmodium, ingresa al organismo a través de la picadura de un mosquito Anopheles hembra infectado. Los niños, las mujeres embarazadas, los portadores del VIH y las personas que nunca tuvieron contacto con el patógeno corren un riesgo mayor de desarrollar la forma más grave de la enfermedad, que causa 600.000 muertes al año en todo el mundo, casi todas (un 95 %) en África. Un estudio dirigido por científicos brasileños publicado en febrero en la revista Cell Metabolism dilucida un mecanismo de autorregulación que, en la malaria, tal como también se la conoce a esta enfermedad, evita una respuesta exacerbada del sistema inmunitario. Al hacerlo, el sistema de defensa evita daños en el cuerpo humano, pero favorece la multiplicación del protozoo y, con ello, el agravamiento de la enfermedad.
En experimentos con un modelo animal que simula el paludismo humano, el equipo del inmunólogo Ricardo Gazzinelli, de la Universidad Federal de Minas Gerais (UFMG) y de la Fundación Oswaldo Cruz (Fiocruz), descubrió que la segunda fase de la activación del sistema inmunitario, en la cual el organismo se prepara para actuar con todas sus fuerzas contra el invasor, no funciona como se esperaba. En la malaria, una señal química que induce la maduración de las células dendríticas, responsables de amplificar la respuesta inmunitaria reclutando un mayor número de células de defensa contra el invasor, causa el efecto opuesto al deseado. En lugar de preparar a las células dendríticas para reclutar a otras con acción específica contra el parásito, esta señal desorganiza el funcionamiento de estas células y frena la respuesta inmunitaria. ¿Cuál es el resultado? El protozoo gana tiempo para reproducirse sin ser importunado, intensificando los síntomas de la enfermedad.
“Esta alteración en la actividad de las células dendríticas es una forma de autorregulación inmunológica”, explica Gazzinelli, también docente en la Universidad de Massachusetts (EE. UU.), donde se realizaron parte de los experimentos con el apoyo de la FAPESP. “Evita la hiperactivación del sistema inmunitario, que podría resultar dañina para el individuo. Esto protege al organismo del hospedante, pero propicia la multiplicación del parásito”.
En el paludismo, del mismo modo que en las infecciones mediadas por virus o bacterias, la señal de amplificación de la respuesta inmunitaria la da una proteína llamada interferón gamma, un mensajero químico producido por ciertas células específicas de defensa expuestas al invasor al principio de la infección. El interferón gamma liberado por las células natural killers [NK] y por los linfocitos T que entraron en contacto con el parásito en la primera oleada de la respuesta inmunitaria, dispara en el bazo la fase siguiente del combate. En este órgano del tamaño de un puño que forma parte del sistema inmunitario y se encuentra alojado en la parte superior izquierda del abdomen, la señalización estimula a las células de defensa en reposo (los monocitos) para que se transformen en células dendríticas, que eventualmente envuelven al parásito, los despedazan y presentan estos fragmentos a otro grupo de células, los linfocitos T CD8+. Estos, a su vez, activan a otros componentes del sistema de defensa capaces de destruir las células infectadas. Ello, por supuesto, cuando todo sale según lo previsto.
Pero en el caso del paludismo parece ocurrir algo diferente, según pudo constatar la bióloga Theresa Ramalho. Durante una pasantía posdoctoral que ella realizó en Massachusetts bajo la supervisión de Gazzinelli, infectó a ratones con Plasmodium chabaudi, un parásito que causa el paludismo en roedores, y analizó el comportamiento de las células dendríticas del bazo.
Ramalho observó que el interferón gamma desorganiza el funcionamiento de esas células. Inicialmente, la señal induce algo previsible e incluso deseable en las células que desempeñan una actividad intensa: un aumento del consumo de glucosa, la principal fuente de energía.
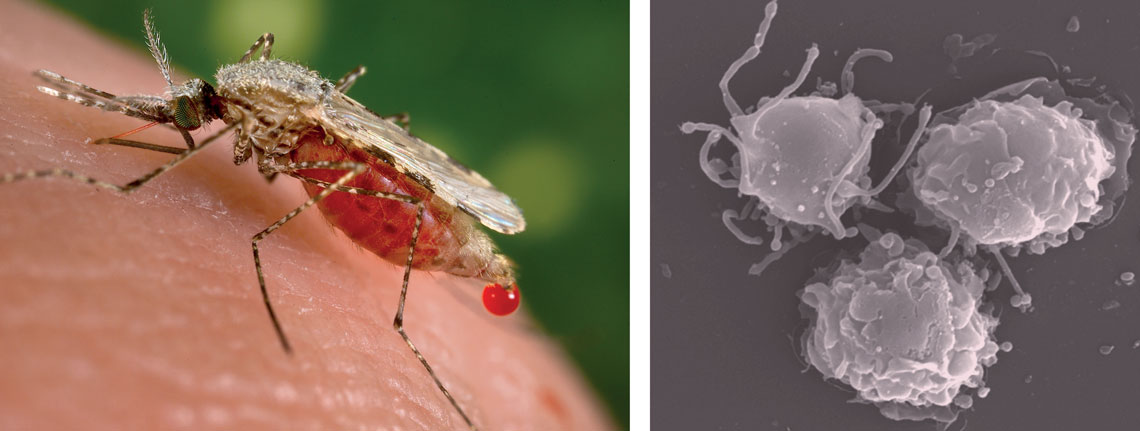
Hembra del mosquito Anopheles stephensi, uno de los transmisores del paludismo, y células dendríticas, cuyo funcionamiento se ve alterado en la enfermedad, vistas bajo un microscopio electrónicoJim Gathany / CDC | Laboratorio de Ricardo Gazzinelli / UFMG
El problema reside en que, en el paludismo, el ciclo de transformación de la glucosa en energía no llega a completarse. En las células dendríticas, el interferón gamma estimula la producción de una proteína que interrumpe el proceso a mitad de camino. Esta proteína, la enzima aconitato deshidrogenasa 1 (Acod1), impide que la digestión de la glucosa concluya y transforma el azúcar parcialmente digerido en itaconato, un compuesto que pasa a acumularse en estas células e impide el normal funcionamiento de las mitocondrias, las centrales energéticas celulares. “En las células dendríticas de los roedores infectados, los niveles de itaconato eran 35 veces más altos que lo normal. En la sangre, cuatro veces más”, dice Ramalho, autora principal del estudio.
Capaz de impedir el crecimiento de bacterias, el itaconato no posee el mismo efecto microbicida contra los protozoarios, que también son organismos unicelulares pero más complejos. El aumento de los niveles de itaconato en las mitocondrias daña a estos orgánulos y desencadena una secuencia de fenómenos en las células dendríticas que les impiden activar a los linfocitos T CD8+. “El parásito aprovecha esta situación para multiplicarse sin control”, explica la bióloga.
La pruebas con roedores genéticamente modificados para que no produzcan Acod1 ‒y no acumulen itaconato‒ demostraron que la ausencia de esta enzima fue suficiente para restablecer la activación de los linfocitos T CD8+. “Sin el itaconato, los ratones combatieron mejor la infección y la cantidad de plasmodio en sangre fue menor”, informa la investigadora.
La acumulación de itaconato observada en este modelo experimental del paludismo también parece producirse en la enfermedad humana. Los investigadores comprobaron que, en las personas infectadas con Plasmodium falciparum, predominante en el continente africano y causante de la forma más letal de la malaria, las células dendríticas producían más Acod1. Se constató algo similar en la infección por Plasmodium vivax, el más común fuera de África y generalmente asociado a una enfermedad más leve. Los niveles de itaconato eran más altos en la sangre de las personas infectadas con esta especie del parásito.
Expertos en paludismo que no participaron en el estudio afirman que los hallazgos son prometedores y pueden contribuir a la formulación de nuevas terapias contra el plasmodio. “Tanto el itaconato como la enzima Acod1 pueden convertirse en blanco de posibles intervenciones clínicas”, dice la bióloga Cristiana de Brito, de la Fiocruz. A su juicio, el itaconato incluso podría convertirse en un marcador de la enfermedad. “La medición de sus niveles en sangre tal vez permita identificar a las personas con más riesgo de evolucionar a un cuadro de paludismo grave”, explica.
La biomédica Silvia Boscardin, de la Universidad de São Paulo (USP), comparte ese mismo punto de vista Para ella, este estudio proporciona indicios convincentes de que el itaconato también puede desempeñar un papel inmunosupresor en humanos. “Esto abre la posibilidad de probar, cuando estén disponibles para uso clínico, posibles fármacos que reduzcan la acumulación de este compuesto con miras a evaluar si pueden mejorar la condición clínica de los pacientes”, sostiene.
Proyecto
Mecanismos inmunológicos de resistencia y patogénesis del paludismo (nº 16/23618-8); Modalidad Proyecto Temático; Investigador responsable João Santana da Silva (USP-RP); Inversión R$ 7.350.121,64.
Artículo científico
RAMALHO, T. et al. Itaconate impairs immune control of Plasmodium by enhancing mtDNA-mediated PD-L1 expression in monocyte-derived dendritic cells. Cell Metabolism. 6 feb. 2024.