Investigadores de la Universidad de São Paulo (USP) están ayudando a desentrañar las alteraciones en el funcionamiento de las células de la retina que causan problemas en la vista a un alto porcentaje de bebés prematuros, que en algunas regiones y países llega a superar el 30 %. La retina, situada en la parte posterior del globo ocular, es la estructura encargada de captar la luz y convertirla en señales eléctricas que al llegar al cerebro generan las imágenes. Y no empieza a madurar sino en las últimas semanas del embarazo. Cuando el bebé nace antes de la 32ª semana de gestación o con un peso inferior a 1,5 kilogramos, y requiere de ciertos cuidados, como un suplemento de oxígeno en una Unidad de Terapia Intensiva (UTI) neonatológica, la retina no madura correctamente. Al retirársele el oxígeno, los vasos sanguíneos que la nutren proliferan de manera exagerada, pueden dejar cicatrices en el fondo del ojo y provocar la pérdida de la visión. Esta condición, conocida como retinopatía del prematuro, es una de las causas principales de ceguera infantil: fue lo que causó que el músico y cantante estadounidense Stevie Wonder perdiera la vista.
Mediante el uso de ratones criados en condiciones similares a las de los bebés recién nacidos que pasan un período en cuidados intensivos, los bioquímicos Ricardo Giordano y Sayuri Miyamoto, ambos del Instituto de Química (IQ) de la USP, y sus colaboradores, ahora han identificado alteraciones en la disponibilidad de los lípidos (grasas) en la retina y en el uso que esta hace de dichos compuestos. Los resultados, que salieron publicados en el mes de junio en la revista iScience, ayudan a entender por qué las células de esta estructura de los ojos pueden dejar de funcionar correctamente.
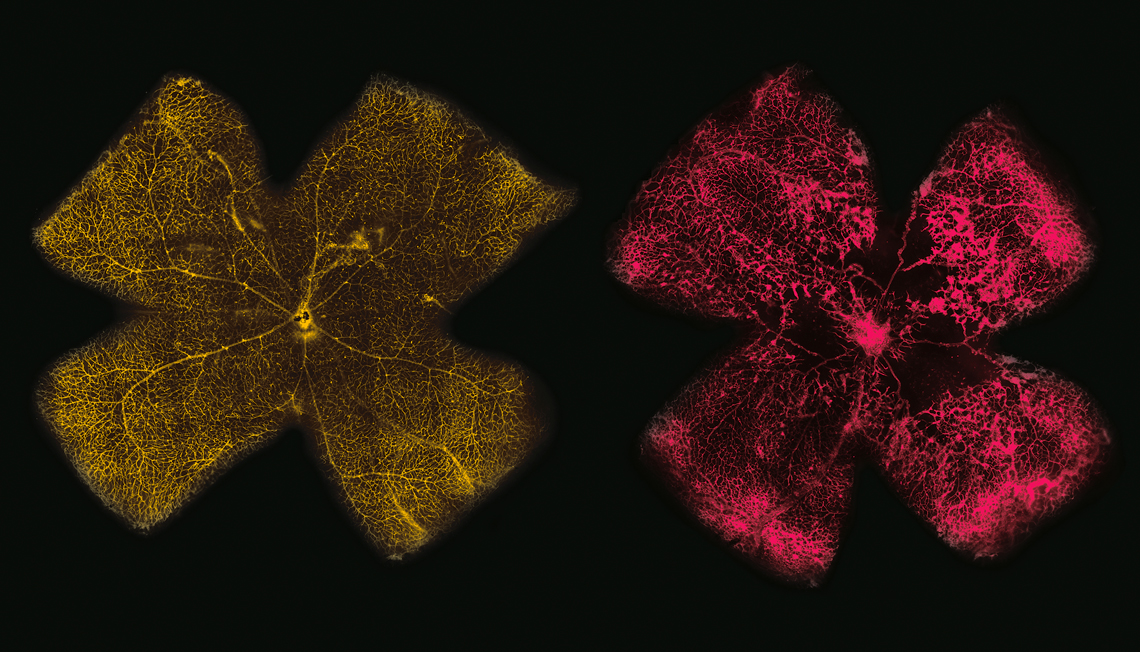
A medida que avanzaba la proliferación de los vasos sanguíneos en el experimento con los roedores, los bioquímicos Alex Inague y Lilian Alecrim, estudiantes de doctorado bajo la dirección de Miyamoto y Giordano, respectivamente, advirtieron una alteración importante en las cantidades de 277 (el 92 %) de los 300 tipos de lípidos que naturalmente se encuentran en las células de la retina. Los lípidos son moléculas orgánicas constituidas por largas secuencias de átomos de carbono (C), a las que se unen átomos de hidrógeno (H), oxígeno (O), nitrógeno (N) y fósforo (P). Forman diversos tipos de aceites y grasas y desempeñan roles clave para el organismo. Son los componentes principales de la membrana, la envoltura fluida que separa los orgánulos celulares del medio exterior y controla el ingreso de compuestos en las células, además de oficiar como fuente de energía. También cumplen funciones como la de señalización química, enviando información tanto al interior de las células como a otros tejidos.
En la retina, la disponibilidad de lípidos y su desempeño apropiado en las reacciones químicas son aún más importantes. Sucede que sus células, al igual que las del corazón y de otros músculos, exhiben un alto consumo de energía. Para mantenerse activas, consumen tanto la energía disponible en las moléculas de glucosa como la que almacenan ciertos tipos de lípidos. Además, estas células se degradan en forma acelerada al interactuar con la luz y las moléculas de oxígeno y necesitan reemplazar a los lípidos dañados para mantenerse intactas y sobrevivir. Se calcula que cada día, las células receptoras de la luz (denominadas fotorreceptores) sustituyen hasta el 10 % de los lípidos de la capa externa de su membrana.
Inague y Alecrim midieron las concentraciones de lípidos en diferentes fases de la retinopatía y observaron tres fenómenos principales. El primero era un aumento en la retina enferma de la cantidad de lípidos neutros, moléculas apolares que, en general, funcionan como reserva de energía: sus niveles eran al menos tres veces más altos que los hallados en el tejido sano. En la retinopatía, los lípidos neutros también parecieron agruparse en el interior de las células formando minúsculas gotitas, dentro de las cuales se hallaron lípidos más sensibles a la acción de las moléculas de oxígeno. Tanto el aumento del nivel de estos lípidos como el de la formación de microgotas fueron corroborados por la mayor expresión de genes que codifican las proteínas asociadas a la síntesis de esos compuestos y al ordenamiento de estas vesículas de grasa en las células. En un artículo publicado en 2015 en la revista Cell, el equipo de investigación de Alex Gould, del Instituto Francis Crick, en el Reino Unido, comprobó que estas gotículas, que albergan los ácidos grasos más flexibles de la membrana, nos protegen de la acción dañina de las moléculas del oxígeno. “Es como si, al hallarse enfermas, las células intentasen resguardar su material más noble”, dice Inague.
El tercer fenómeno fue una disminución importante de la disponibilidad de ácidos grasos de los tipos omega 3 y omega 6, seguida de un incremento significativo de los ácidos grasos omega 9. Esta disminución era de esperarse, ya que el nacimiento detiene el suministro que le llegaba al bebé por vía placentaria. Por este motivo, a veces los médicos les administran a los recién nacidos suplementos nutricionales que contienen omega 3 y omega 6 para tratar de prevenir los daños en la retina. Pero los resultados no siempre son satisfactorios. “Aparentemente hay una alteración metabólica que el suplemento no proporciona. Quizá sea por ello que no es completamente efectivo”, explica Miyamoto.
“Los estudios de este tipo son importantes porque arrojan luz sobre los mecanismos implicados en el desarrollo de la enfermedad”, dice la oftalmóloga Eliane Chaves Jorge, de la Facultad de Medicina de la Universidade Estadual Paulista (Unesp), especializada en retinopatía de bebés prematuros. “Los resultados revelan que en la retinopatía se produce una remodelación lipídica [una alteración en la concentración, la disponibilidad y la utilización de estas moléculas] que puede explicar por qué la suplementación con omega 3 y omega 6 no siempre tiene el efecto esperado”, explica la médica.
En 2019, el equipo de Giordano ya había analizado cómo evolucionaba la actividad de los genes en las células de la retina de los roedores con retinopatía del prematuro. Por entonces, los investigadores notaron un aumento en la activación de alrededor de 3.000 genes, en su mayoría asociados a la formación de nuevos vasos sanguíneos (angiogénesis). “En el primer estudio, observamos la expresión génica, pero nos percatamos de que ella no permitía explicar todo lo que ocurría con las células de la retina en esta enfermedad. Por ello, a continuación estudiamos los lípidos. Ahora estamos analizando qué sucede con las proteínas”, comenta Giordano. “Pretendemos entender todo lo que está ocurriendo”.
Proyectos
1. Los mecanismos moleculares de la angiogénesis y de la heterogeneidad vascular (nº 19/25828-8); Modalidad Proyecto Temático; Investigador responsable Ricardo José Giordano (IQ-USP); Inversión R$ 1.768.922,73.
2. Redoxoma (nº 13/07937-8); ModalidadCentros de Investigación, Innovación y Difusión (Cepid); Investigadora responsable Ohara Augusto (IQ-USP); Inversión R$ 62.754.313,69.
3. Mecanismos de detoxificación y reparación de membranas biológicas oxidadas mediante la acción de la enzima peroxirredoxina VI (nº 17/13804-1); Modalidad Beca de doctorado directo; Investigadora responsable Sayuri Miyamoto (IQ-USP); Becario Alex Inague; Inversión R$ 235.935,57.
Artículo científico
INAGUE, A. et al. Oxygen-induced pathological angiogenesis promotes intense lipid synthesis and remodeling in the retina. iScience. v. 26, n. 6. 16 jun. 2023.