De pie en una sala oscura, la veterinaria y embrióloga Ligiane Leme observaba atentamente la pantalla de una computadora, única fuente de luz del lugar. Eran poco más de las 11 de la mañana del día 10 de abril y el monitor mostraba la imagen de un óvulo inmaduro, sostenido por una micropipeta junto a una diminuta aguja. En pocos segundos, la embrióloga Georgina Hastenreiter movió la aguja con ayuda de un joystick y realizó una mínima perforación en la célula, a través de la cual, con movimientos rápidos y precisos, extrajo todo su material genético. Luego, el óvulo sin núcleo fue rellenado con el ADN de una célula adulta de piel de cerdo.
Durante ese día y el siguiente, Leme, Hastenreiter y la científica biomédica Tainah Moraes repetirían el mismo procedimiento con otros 600 óvulos recolectados en un matadero del interior de São Paulo. Las células reproductoras de las cerdas fueron acondicionadas en un medio de cultivo y transportadas al Centro de Estudios del Genoma Humano y de Células Madre de la Universidad de São Paulo (CEGH-CEL-USP), financiado por la FAPESP, en donde serían utilizadas en la etapa siguiente de un proyecto ambicioso: el intento de producir en Brasil clones de animales genéticamente modificados para proporcionar órganos a seres humanos y, de ese modo, tal vez, reducir la lista de espera para trasplantes de órganos. Según los datos suministrados por el Ministerio de Salud nacional, en abril había 71.000 personas esperando por un órgano o tejido donado.
“El país tiene el mayor sistema público de trasplante de órganos del mundo”, recuerda Ernesto Goulart, farmacéutico especializado en bioingeniería de tejidos y líder del proyecto de la USP. “Creemos que tenemos la obligación de desarrollar una estrategia que le permita a este sistema seguir funcionando bien y con una capacidad mayor de atención”, afirma el investigador.
El proyecto está coordinado por la genetista Mayana Zatz, del CEGH-CEL, y por el cirujano Silvano Raia, de la Facultad de Medicina (FM-USP). Recibió un financiamiento inicial de la empresa farmacéutica EMS y cuenta con financiamiento de la FAPESP y del gobierno federal. Actualmente participan alrededor de 50 investigadores de la USP y de la estatal Empresa Brasileña de Investigación Agropecuaria (Embrapa), de la Universidad Federal de São Paulo (Unifesp) y del Instituto de Investigaciones Tecnológicas (IPT).
“El trasplante de órganos fue el mayor avance en la historia de la cirugía. De 2000 a 2022 se realizaron 2 millones en todo el mundo. Como son recomendados para evitar la muerte, podemos afirmar que se salvaron 2 millones de vidas”, afirma Raia. “Debido al éxito, existe una demanda no atendida. Esto justifica la búsqueda de órganos adicionales”, afirma el cirujano, pionero en el mundo en la realización de trasplantes de hígado con donantes vivos.
Al final de aquellos dos días de abril, las investigadoras habían obtenido 280 embriones clonados, que fueron transferidos a los úteros de dos hembras híbridas de las razas landrace y large white. Si todo sale según lo previsto, a mediados de mayo se podrá saber si las cerdas están preñadas y con cuántas crías. Se espera que, después de casi cuatro meses de gestación, se pueda presenciar el nacimiento de, al menos, un lechón.
El apoyo es enorme, a pesar de la baja tasa de éxito de la técnica. Sólo una pequeña parte de los embriones obtenidos mediante clonación y transferidos a las hembras receptoras se implantan en el útero y, de ellos, una fracción aún menor (del 1% al 5%) completa la gestación y nace.
Cuando la clonación tenga éxito, pretendemos estar preparados para probar las células editadas, afirma Goulart, de la USP
En el último año, el equipo de Leme ha producido más de 10.000 embriones de cerdo clonados y ha concretado 20 transferencias a receptoras, insertando alrededor de 200 a la vez. En cada ocasión las hembras quedaban preñadas y, en algunos casos, los fetos se desarrollaban hasta 50 días, casi la mitad del tiempo de gestación de un cerdo. Hasta la fecha, ninguna preñez ha dado como resultado el nacimiento de un lechón, algo que las investigadoras esperan que cambie pronto, con las mejoras aplicadas en cada nuevo intento. “En Brasil, la clonación de ganado se practica desde hace algún tiempo, pero esta tecnología aún no se ha afianzado en los cerdos”, afirma Goulart. “El uso de la técnica en puercos es más limitado, debido a las características de los gametos de la especie”, explica Leme.
La dificultad para dominar la técnica es una cuestión mundial. Unos 15 grupos en al menos ocho países están intentando clonar cerdos genéticamente modificados para obtener órganos, pero solamente tres lo han logrado. Uno es de la empresa eGenesis, de Estados Unidos, proveedora del riñón trasplantado en marzo a un hombre con insuficiencia renal.
Todo puede afectar la obtención de un clon: la temperatura a la que se manipulan las células, la incidencia de la luz (por eso la habitación debe estar a oscuras), la sincronización entre la etapa de división de la célula donante de ADN y la del óvulo, además de la fase del ciclo reproductivo en la que los embriones se transfieren a la receptora y del número de embriones realmente implantados en el útero. Las cerdas tienen de 20 a 25 lechones por camada y, si la cantidad de embriones es mucho menor, la gestación no avanza. Para mejorar la clonación, a partir de abril, el equipo de la USP comenzó a contar con la asesoría del veterinario y embriólogo brasileño Luis Queiroz, quien colaboró en el desarrollo de los animales de eGenesis.

Tulio Yoshinaga / Cegh-Cel / USPCélulas de piel genéticamente modificadasTulio Yoshinaga / Cegh-Cel / USP
La obtención de los primeros lechones clonados será la confirmación de que el grupo de la USP finalmente domina la técnica, un paso esencial y complementario al otro que también es necesario para obtener órganos más compatibles con los del ser humano: la edición genética de células. A pesar de las diferencias genéticas y de otras incompatibilidades, los cerdos han sido los animales donantes preferidos por los científicos en los últimos años porque tienen órganos similares, en tamaño y función, a los humanos, además de estar domesticados, reproducirse bien en cautiverio y producir grandes camadas en unos pocos meses.
Hace cinco años, antes de los intentos de clonación, Goulart y los biólogos Luiz Caires y Luciano Abreu Brito habían iniciado las primeras pruebas para alterar la configuración genética de las células porcinas y, de ese modo, reducir uno de los principales riesgos del trasplante: el rechazo. Como consecuencia del ataque del sistema de defensa del receptor al nuevo órgano, el rechazo también puede producirse cuando los donantes son seres humanos. Pero suele ser más común con órganos de otros animales, los denominados xenotrasplantes.
Instalados en el Laboratorio de Edición Genética del CEGH-CEL, en una sala contigua a la de clonación, Goulart, Brito y sus colaboradores emplean dos técnicas para manipular el material genético de las células que se utilizarán en la generación de clones. Una de ellas es la herramienta de edición genética Crispr-Cas 9 (lea en Pesquisa FAPESP, edición nº 288).
Con esa herramienta, el equipo de la USP ha logrado desactivar los tres genes normalmente desconectados en experimentos de xenotrasplantes: GGTA1, CMHA y B4GALNT2. Dichos genes codifican enzimas que actúan en la producción de azúcares en la superficie de las células porcinas que son reconocidas por el sistema inmunológico humano y desencadenan un rechazo hiperagudo: el órgano es destruido en las primeras horas o días después del trasplante, provocado por los anticuerpos presentes en la sangre del receptor.
Más recientemente, el grupo empezó a utilizar una segunda técnica, llamada transposon piggybac, que utiliza un tramo de ADN capaz de cortar la doble cadena de material genético celular e insertar nuevos segmentos, para añadirles siete genes humanos a las células porcinas. El objetivo es generar células – y, en consecuencia, embriones y órganos – con características más parecidas a las humanas para burlar el sistema de defensa y evitar la producción de nuevos anticuerpos, causantes del rechazo agudo, que puede producirse meses después del trasplante. “Todo el proceso de edición genética, especialmente el agregado de genes, es delicado. Representa un ataque a las células”, explica Brito.
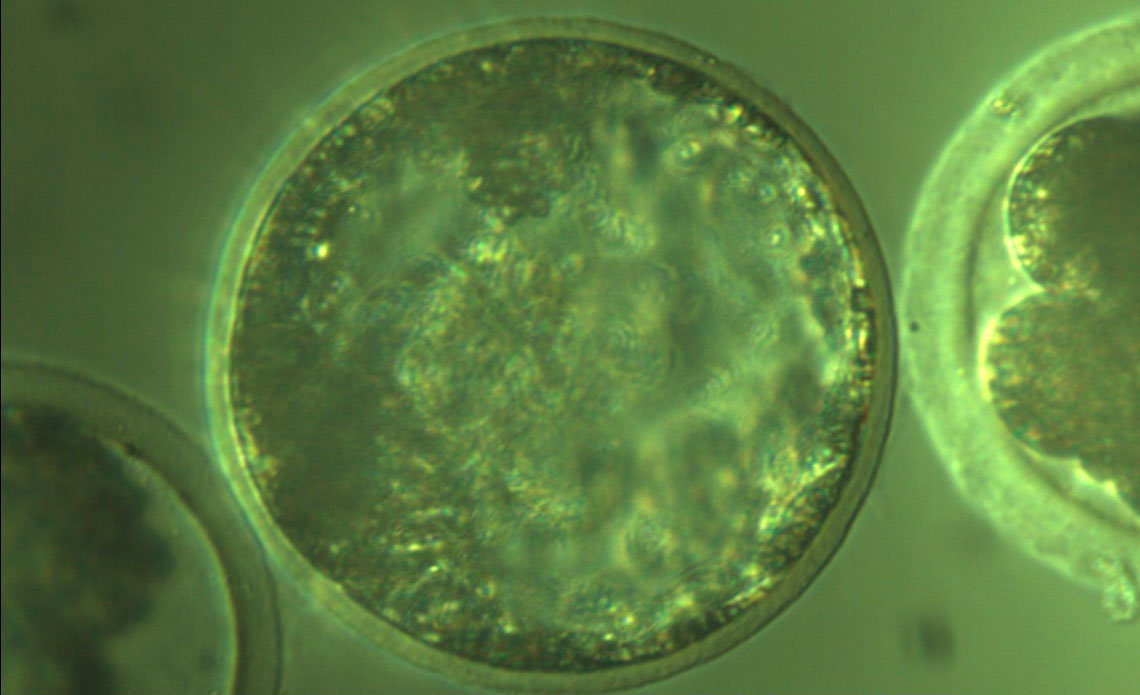
Ligiane Leme / Cegh-Cel / USPUn embrión de cerdo clonado (la esfera central, a la derecha)Ligiane Leme / Cegh-Cel / USP
Hasta abril, los investigadores habían logrado insertar los genes en los fibroblastos, las células de la piel que resultaron más adecuadas para la clonación, pero aún no sabían si habían sido incorporados en la sección deseada del genoma ni si permitían la producción de niveles adecuados de las proteínas codificantes. Por tal motivo, planeaban secuenciar el ADN de los fibroblastos para ver el punto de inserción de los genes.
“Cuando la clonación tenga éxito, pretendemos estar preparados para probar las células editadas”, afirma Goulart, que espera obtener, además de riñones, córneas, corazones y piel para xenotrasplantes. Los cerdos clonados y las crías resultantes del cruzamiento entre ellos serán mantenidos en dos instalaciones especiales, diseñadas para criar animales donantes de órganos para uso humano. La primera, con capacidad de hasta 10 animales, fue inaugurada el 23 de abril en el campus de la USP, en São Paulo. Se está construyendo otra más grande en el IPT. Después de nacidos, los animales serán cuidados por XenoBR, una startup resultante del proyecto que proveerá los órganos para las pruebas clínicas.
El avance de las técnicas de edición génica en la última década, con la promesa de reducir el riesgo de rechazo, ha reavivado el interés médico por los órganos de origen animal, una antigua búsqueda documentada desde el siglo XVII aproximadamente (vea la cronología a continuación). Desde 2022, al menos tres pacientes críticos han recibido trasplantee de órganos porcinos como última alternativa (tratamiento compasivo).

