La técnica de edición génica a la cual se la conoce por la sigla CRISPR-Cas9, considerada revolucionaria, comienza a tornar más próxima a la realidad la alteración o sustitución de genes para tratar o evitar enfermedades. El resultado de su primer uso en seres humanos fue descrito en septiembre de 2019 en un artículo que salió publicado en la revista New England Journal of Medicine. En ese trabajo, el inmunólogo Deng Hongkui y su equipo en la Universidad de Pekín, en China, relataron un test pionero aplicado a un individuo de sexo masculino de 27 años que padecía leucemia, un tipo de cáncer causado por la proliferación de células de defensa inmaduras, que además era portador de VIH, el virus del sida. Luego de controlar esas enfermedades con medicamentos, en 2017, los investigadores sometieron al paciente a un tratamiento innovador. Tanto la leucemia como la infección por VIH afectan a las mismas células inmunitarias, los linfocitos, que atacan a los organismos invasores y a las células enfermas. Como la solución implicaba restaurar la producción de linfocitos saludables, los médicos decidieron combatir ambos problemas con un trasplante especial. Extrajeron células de la médula ósea de un donante y, antes de transferirlas al paciente, se valieron de la técnica CRISPR para desactivar el gen que contiene la fórmula de una proteína que el VIH utiliza para invadir a los linfocitos. De esa manera, esperaban restablecer la producción de células defensivas sanas e inmunes al virus, tal como ya había ocurrido con Timothy Ray Brown, conocido como el paciente de Berlín, luego de recibir la médula de un donante que naturalmente no producía esa proteína.
El éxito fue parcial. Los científicos trasplantaron una mezcla de células editadas y no editadas (no fue posible modificarlas a todas). Un año y medio después, la leucemia seguía en remisión y la nueva médula continuaba produciendo linfocitos sanos, aunque solo el 5% de ellos exhibía la alteración protectora. “El test fue concebido para evaluar la seguridad y viabilidad del trasplante”, sostuvo Deng en una comunicación vía e-mail con Pesquisa FAPESP. El experimento funcionó como prueba de principio e indicó que la realización del procedimiento es factible y aparentemente no causa daños. No obstante, antes de evaluar la eficacia de la estrategia para doblegar a la infección por VIH, será necesario elevar la eficiencia de la edición y perfeccionar el protocolo de trasplante. Lo ideal es que todos los linfocitos se tornen inmunes al virus. “Resolvimos dedicarnos a mejorar la técnica antes de tratar a otros pacientes”, relató el inmunólogo.
La técnica CRISPR no es la primera ni la única forma de modificar o desactivar genes testeada en seres humanos. La idea de que era posible recortar el material genético de las células en puntos específicos y alterarlo –insertando un nuevo gen o desactivando otro con actividad indeseada– surgió a partir del hallazgo de un sistema de defensa de las bacterias. En los años 1960, los científicos estadounidenses Hamilton Smith y Daniel Nathans (1928-1999) junto al suizo Werner Arber, identificaron en esos organismos unas proteínas denominadas nucleasas, que funcionan como tijeras moleculares y cortan el material genético (ADN) de los virus invasores en puntos específicos. Ese descubrimiento le valió al trío el Premio Nobel de Medicina de 1978 y condujo al desarrollo de estrategias para modificar el ADN de las células.
Dos técnicas propuestas en las décadas de 1990 y 2000 se basaban en ese principio: la edición con nucleasas con dedos de zinc (zinc finger nucleases, o ZFN) y con nucleasas efectoras del tipo activador de transcripción (transcription activator-like effector nucleases, o TALEN). Ambas utilizan una proteína artificial, formada por la unión de otras dos: una que reconoce el segmento del material genético y otra que lo recorta. Las mismas funcionan de manera precisa y se las está evaluando en animales y en seres humanos. Hay en curso una docena de ensayos clínicos con la ZFN y la mitad de esa cantidad con la TALEN (lea el reportaje en la página 20). Empero, existe un problema. Las proteínas son moléculas grandes, complejas y resulta difícil producirlas en laboratorio. Otra complicación radica en que se necesita diseñar una nueva proteína para cada tramo apuntado del ADN.
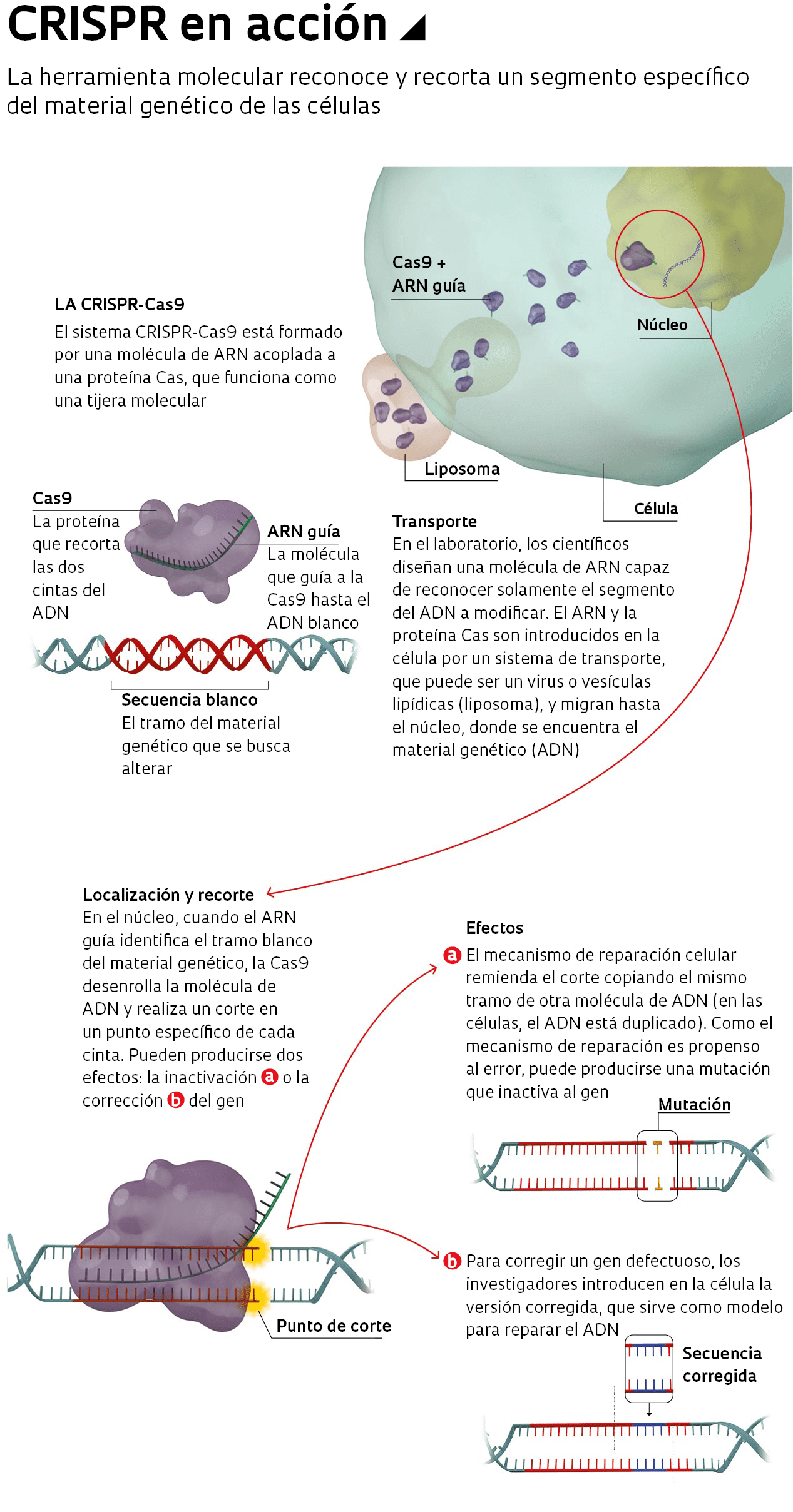
En eso la CRISPR lleva una ventaja. Ella también utiliza una molécula híbrida, pero en este caso está formada por una proteína (la Cas) y un ARN, que es bastante menor y más simple de diseñar en laboratorio (vea la infografía arriba). En 2012, la bioquímica estadounidense Jennifer Doudna, de la Universidad de California en Berkeley, Estados Unidos, y la genetista francesa Emmanuelle Charpentier, que en la actualidad trabaja en el Instituto Max Planck, en Alemania, crearon una versión simplificada del sistema CRISPR-Cas y demostraron que la misma funcionaba en pruebas con ADN. Al año siguiente, el bioquímico chinoestadounidense Feng Zhang, del Instituto Broad, en Estados Unidos, empleó esa estrategia para manipular el ADN de células humanas. Esos resultados, que salieron publicados en la revista Science, fueron el punto de partida de una carrera mundial para dominar la técnica, así como una disputa por los derechos de propiedad intelectual entre Berkeley y el Broad (lea en Pesquisa FAPESP, edición nº 269).
“La producción de secuencias cortas de ARN en laboratorio es algo trivial y barato, lo que convierte a la CRISPR en una técnica más versátil y accesible que cualquier otro método de edición génica”, dice el genetista Carlos Menck, de la Universidad de São Paulo (USP). En colaboración con la investigadora Clarissa Rocha, de la Universidad Federal de São Paulo (Unifesp), él utiliza la CRISPR para identificar a los genes que confieren resistencia a los medicamentos a las células tumorales.
A causa de esa simplicidad y de su versatilidad, en poco tiempo, investigadores de todo el mundo comenzaron a testear la CRISPR en plantas y animales con los objetivos más dispares, desde perfeccionar la producción de alimentos hasta la creación de modelos para el estudio de enfermedades humanas. Ratones, ratas, conejos, cerdos, perros y monos ya han sido alterados genéticamente mediante la técnica CRISPR, muchos de ellos en forma pionera por científicos chinos. Menos de cinco años después de la publicación de los artículos en la Science, aparecieron trabajos que demuestran que es posible corregir genes defectuosos en embriones humanos y comenzaron los tratamientos experimentales en humanos.
Los ensayos en humanos
Más allá del caso tratado en China, el primer test en humanos con sus datos consignados en una publicación científica, se informó de otros cinco más recientes. Al comienzo del pasado mes de noviembre, el equipo del médico Edward Stadtmauer, de la Universidad de Pensilvania, en Estados Unidos, presentó los datos iniciales del uso de células inmunitarias que, por medio de la técnica CRISPR, recibieron un gen que las guiaba para acometer a dos tipos de tumores (mieloma múltiple y sarcoma) y simultáneamente se había inhibido a otros que frenan la acción de esas células. Seis meses después del tratamiento, los pacientes no evidenciaron efectos colaterales graves. Una mujer con mieloma había mejorado y se había detenido el avance del sarcoma del segundo paciente. Del tercero no había resultados, informaron los investigadores en la reunión anual de la Sociedad Americana de Hematología de 2019.
También en el mes de noviembre, la empresa farmacéutica estadounidense Vertex Pharmaceuticals y la suiza CRISPR Therapeutics anunciaron el éxito inicial de la técnica CRISPR para el tratamiento de una paciente con talasemia beta y otra con anemia falciforme, enfermedades genéticas que inducen la producción de una forma alterada de hemoglobina, la proteína que transporta el oxígeno en la sangre. Ellas forman parte de unos ensayos clínicos en los cuales 45 participantes reciben célula de su propia médula editadas para el tratamiento de la enfermedad. Meses después de esa terapia, la paciente con talasemia beta ya no necesitaba transfusiones de sangre y la mujer con anemia falciforme ya no presentaba lesiones en los órganos provocadas por el bloqueo de los vasos sanguíneos, como consecuencia de la acumulación de hematíes deformes. “Estos datos afianzan nuestra creencia de que estas terapias podrán aportar un beneficio significativo a los pacientes luego de una única intervención”, dijo en ese entonces Samarth Kulkarni, el presidente de CRISPR Therapeutics, en un comunicado a la prensa.
En ese tratamiento, los investigadores usaron la técnica CRISPR para introducir una anomalía en el gen BLC11A y desactivarlo. De esa manera, reactivaron la producción de hemoglobina fetal, que se sintetiza durante la vida intrauterina. Incluso en una cantidad moderada, la hemoglobina fetal reduce el efecto nocivo de la hemoglobina defectuosa. En Brasil, el equipo del hematólogo Fernando Costa, de la Universidad de Campinas (Unicamp), intenta reproducir ese tratamiento introduciendo una modificación. En lugar de inducir en el BLC11A mutaciones desconocidas, tal como hicieron las empresas, él y la bióloga Priscila Martin optaron por utilizar una alteración ya identificada en la década de 1980 en la población brasileña. Esa mutación incrementa la producción de hemoglobina fetal en la vida adulta sin afectar otros genes. Costa y Martin ya introdujeron esa alteración en linajes de células humanas, las cuales comenzaron a producir hemoglobina fetal en mayor cantidad. El grupo está repitiendo el procedimiento en ratones con anemia falciforme. “Si la cantidad de hemoglobina fetal llega a niveles cercanos a un 25% del total de la hemoglobina, puede que dejen de producirse lesiones por obstrucción en lo vasos sanguíneos”, comenta Costa.
Al comienzo de este año estaban en curso 16 ensayos clínicos, entre ellos, los dos de Vertex y de CRISPR Therapeutics. Se trata de test iniciales, destinados a evaluar la seguridad y, hasta cierto punto, la eficiencia de la edición génica mediante la técnica CRISPR. La mayor parte de ellos (11) utiliza la técnica para alterar el funcionamiento de las células inmunológicas y liberarlas para que ataquen a diversos tipos de cáncer (linfoma, leucemia, esófago, estómago y pulmón). Los restantes intentan morigerar o corregir los daños causados por enfermedades hereditarias causadas por un gen defectuoso, tal como ocurre en los casos de la talasemia beta y la anemia falciforme.
Diez de esos test están en curso en hospitales e institutos de investigación de China y cinco en instituciones estadounidenses. Esa cifra marca un avance en la capacidad del gigante asiático para producir ciencia en el campo de la biotecnología y la medicina, tan es así que ya hay expertos diciendo, acaso con exageración, que la disputa entre estadounidenses y chinos sería similar a la que se dio entre Estados Unidos y la Unión Soviética durante la Guerra Fría. Desde 2013 en adelante, las publicaciones sobre la CRISPR aumentaron 100 veces. Pubmed, la mayor base mundial de artículos y libros del área médica, tenía registrados en aquel año 29 artículos sobre CRISPR-Cas9, y 3.221 para 2019. De los 9.700 trabajos publicados entre 2013 y 2019, un 27% tiene un autor chino y un 29%, al menos un estadounidense.
A pesar del incremento de las investigaciones, todavía es pronto para saber si esa técnica funcionará en seres humanos. Por el momento, solo se conocen los datos preliminares de cinco o seis casos informados. El único test con humanos finalizado involucró a 16 pacientes con cáncer de esófago y se llevó a cabo en el Hospital del Cáncer de Hangzhou, en China. Sin embargo, los resultados no fueron divulgados. De cualquier modo, algunos dicen que en pocos años la CRISPR hará realidad la terapia génica.
“Esta técnica ya se está empleando para tratar enfermedades en pacientes humanos. No se trata de un escenario hipotético”, sostiene el biólogo molecular Graham Dellaire, de la Universidad Dalhousie, en Canadá, quien estudia los mecanismos de combate contra las células tumorales y la técnica CRISPR. En los últimos años, junto a otros colaboradores, escribieron comentarios acerca de las cuestiones éticas relacionadas con la edición génica, que se tornaron más acuciantes desde que el biofísico chino He Jiankui declaró, en noviembre de 2018, que había creado a los primeros bebés editados mediante CRISPR (lea en la página 19). En diciembre de 2019 fue sentenciado a tres años de prisión, acusado de práctica médica ilegal.
Los primeros pasos
En Brasil, grupos del área de la salud están testeando la CRISPR con diferentes propósitos, desde el tratamiento del cáncer hasta el combate de parásitos tales como el Trypanosoma cruzi, causante del mal de Chagas. Los resultados más avanzados son los del fisiólogo Guilherme Baldo, de la Universidad Federal de Rio Grande do Sul (UFRGS). En el Centro de Terapia Génica del Hospital de Clínicas de Porto Alegre, Baldo y su grupo utilizaron la técnica para desarrollar un tratamiento experimental para la mucopolisacaridosis, un trastorno genético raro que afecta a una de cada 100 mil personas y daña varios órganos, aparte de perjudicar el desarrollo cerebral.
Ciertas alteraciones en el gen de la enzima alfa-L-iduronidasa propician la acumulación de los azúcares denominados mucopolisacáridos, que son tóxicos para las células. El tratamiento más eficaz es el trasplante de médula ósea, que exige la destrucción del sistema inmunológico y debe realizarse antes de los 2 años de edad para disminuir el riesgo de deficiencia intelectual. Una alternativa es la reposición de la enzima, algo que no impide los daños neurológicos y puede costar hasta 1 millón de reales por año.