Ocho meses después de que el virus Sars-CoV-2, el causante del covid-19, fuera detectado por primera vez en humanos en la ciudad de Wuhan, en China, científicos y médicos aún procuran armar el gran rompecabezas que indica cómo responde el sistema inmunológico al patógeno. Es importante saber exactamente cómo combaten y eliminan el virus las personas infectadas y por cuánto tiempo permanecen protegidas de una posible reinfección para poder desarrollar vacunas, medicamentos e incluso para formular las políticas públicas que determinan la necesidad de medidas de distanciamiento social, cuarentenas y confinamientos totales.
Poco a poco, las múltiples investigaciones relacionadas con el covid-19 han aportado piezas al tablero. No obstante, el cuadro sigue sin poder completarse. Por el momento no hay ningún caso comprobado de reinfección sin margen de duda, lo que para los científicos constituye una señal de que aquellos que ya se han infectado han adquirido alguna protección. El grado de esa inmunidad y su duración siguen siendo una incógnita.
La tarea de completar el rompecabezas se hace más difícil dada la novedad que representa el virus y la complejidad del sistema inmunológico humano, al cual se lo compara a veces con una orquesta formada por diversos componentes y otras, con un ejército con sus diferentes subdivisiones y batallones, como así también con una máquina con muchos engranajes. El batallón más popular de esa fuerza de defensa está formado por los anticuerpos, entre los cuales se encuentran las conocidas inmunoglobulinas G (IgG) y M (IgM), detectadas en los test rápidos aplicados en farmacias y laboratorios (véase el recuadro de la página 29). Los anticuerpos son proteínas disueltas en el plasma sanguíneo producidas por los linfocitos B. A la defensa por medio de anticuerpos los médicos le dan el nombre de inmunidad humoral.
Las investigaciones y cuestionarios epidemiológicos generalmente buscan estas clases de anticuerpos para ver qué porcentaje de un determinado grupo de la población ha tenido contacto con el virus. “Solemos decir que la IgG es casi como una cicatriz inmunológica, un vestigio de que el virus anduvo por ahí”, explica el inmunólogo Jorge Kalil, docente de la cátedra de Inmunología Clínica y Alergia de la Facultad de Medicina de la Universidad de São Paulo (FM-USP) y director del Laboratorio de Inmunología del Instituto del Corazón (InCor).
Sin embargo, un estudio chino publicado el 18 de junio en la revista Nature Medicine, reveló que 37 personas que se había comprobado que se infectaron con el Sars-CoV-2 pero se mantuvieron asintomáticas, presentaban niveles menores de IgG en sangre y de anticuerpos neutralizantes (que impiden el ingreso del virus a las células) que los que tuvieron síntomas moderados, a pesar de haber permanecido más tiempo con niveles detectables del virus que los sintomáticos. Además, dos o tres meses después de la infección aguda, los niveles de esos anticuerpos descendieron a una escala que, en el 40% de los casos asintomáticos, se tornó indetectable. En los casos de los que tuvieron síntomas, el 12,9% se convirtieron en seronegativos.
El resultado de la investigación china planteó dudas sobre si las personas con la forma leve de covid-19 serían más susceptibles a una reinfección. Todavía no se ha podido dilucidar ese interrogante, según dicen los expertos. Una posibilidad es que los test no hayan logrado detectar una cantidad mínima de anticuerpos y estos, pese a su escasa cantidad, serían lo suficientemente eficientes como para combatir el virus. De todas maneras, según los autores del artículo, de la Universidad Médica de Chongquing, los resultados sirven para exponer los riesgos de utilizar pasaportes de inmunidad al covid-19, como algunos gobiernos pensaron adoptar, otorgando ventajas de movilidad a las personas recuperadas de la infección por el virus.

Léo Ramos Chaves
Científicos del Instituto de Tecnología en Inmunobiológicos (Bio-Manguinhos), en Río de Janeiro, trabajan en el desarrollo de una vacuna contra el nuevo coronavirusLéo Ramos Chaves“La vinculación de la presencia de anticuerpos del tipo IgG con un pasaporte de inmunidad es una idea que ya ha caído por tierra”, considera la infectóloga Nancy Bellei, de la Universidad Federal de São Paulo (Unifesp). “Hemos observado que muchos pacientes que contrajeron la enfermedad luego de cierto tiempo ya no poseen IgG que reconozca los antígenos virales. Para ella, que lleva a cabo investigaciones en el área de los virus respiratorios desde hace décadas, el resultado de ese estudio en China no es precisamente una sorpresa, al igual que otros que apuntan en la misma dirección, como es el caso de uno divulgado a mediados de julio por científicos del King’s College de Londres, en Inglaterra.
“Tradicionalmente los virus respiratorios no determinan una inmunidad permanente y los individuos a los que infectan no suelen mantener estables los niveles de inmunoglobulina positivos inmediatamente después de la infección”, declara la investigadora. “Pese a ser una novedad para la población humana y de que presenta características patogénicas en otros tejidos además de los respiratorios, el Sars-CoV-2 no deja de comportarse y de ser clasificado como un virus respiratorio”, subraya.
Pero los niveles bajos o incluso la ausencia de IgG en el plasma sanguíneo de las personas que tuvieron la infección, incluso siendo asintomáticas, ¿indicarían que no poseen ninguna inmunidad al nuevo coronavirus? Es muy probable que la respuesta a ese interrogante sea negativa, dicen los infectólogos e inmunólogos. Dos artículos recientes, publicados en los repositorios de preprints medRxiv y bioRxiv señalan que una parte de esos individuos puede desarrollar una intensa respuesta celular de linfocitos T específicos para el Sars-CoV-2 incluso siendo seronegativos. Los linfocitos son uno de los tipos de células de defensa del organismo.
El primer artículo, cuyos autores son científicos de la Universidad de Estrasburgo, en Francia, se refiere a los casos de siete familias que tenían al menos a uno de sus integrantes recuperándose de la forma moderada de covid-19. Seis de un total de ocho parientes que posteriormente desarrollaron síntomas de la enfermedad presentaron respuestas de las células T, pero no anticuerpos contra el nuevo coronavirus.
En el segundo estudio, en este caso de investigadores del Instituto Karolinska, en Suecia, se investigó la respuesta de las células T de memoria en diferentes grupos de personas: donantes de sangre sanos que donaron antes de la pandemia o durante, familiares que convivían con individuos convalecientes y estuvieron expuestos a la enfermedad durante la fase de los síntomas y personas que atravesaban la fase de recuperación de la dolencia y que habían tenido síntomas leves o ningún síntoma, o bien la forma grave de covid-19. Los científicos también observaron una respuesta celular de los linfocitos T muy firme incluso sin la presencia de anticuerpos.
“Los resultados de esos estudios combinados con la ausencia de casos de reinfección por ahora nos brindan una cierta tranquilidad de que es muy probable que tengamos, al menos durante algún período de tiempo, cierto grado de protección. En cuanto a la duración de esa inmunidad, solo el tiempo podrá determinarla”, subraya el infectólogo Reinaldo Salomão, de la Escuela Paulista de Medicina de la Unifesp, investigador responsable de un estudio patrocinado por la FAPESP en el cual se investigarán las respuestas inflamatorias e inmunológicas de los pacientes con covid-19 grave y moderado.

Léo Ramos Chaves
Un profesional de la salud efectúa una extracción de sangre para la realización de un test serológico rápido para covid-19Léo Ramos ChavesSalomão hace hincapié en que uno de los motivos posibles de no haber detectado IgG en las pruebas serológicas de los individuos que se infectaron, tal como se ha demostrado en las investigaciones realizadas hasta ahora, podría estar relacionado con los propios test, que no serían lo suficientemente sensibles y específicos para el Sars-CoV-2. “Eso mismo sucedió también con el VIH. Ahora ya vamos por la cuarta generación de los test para esa enfermedad y han mejorado bastante”.
Por otra parte, los expertos resaltan que incluso un test positivo para IgG no significa necesariamente que el individuo esté protegido contra el virus, toda vez que su análisis no esclarece si se produjeron o no anticuerpos neutralizantes, capaces de evitar que el nuevo coronavirus ingrese en las células humanas. La presencia de IgG en la sangre, subrayan los especialistas, no está obligatoriamente vinculada con la existencia de anticuerpos neutralizantes.
El primer estudio que mostró la posibilidad de una respuesta celular humana sólida contra el nuevo coronavirus, según el inmunólogo Edecio Cunha-Neto, del InCor y de la FM-USP, fue publicado en mayo en la revista Cell por científicos del Instituto de Inmunología de La Jolla, en San Diego, California (EE. UU.).
Más allá de haber observado una fuerte respuesta celular a proteínas que simulaban el Sars-CoV-2 en un grupo de 20 adultos que se recuperaron del covid-19, ellos también notaron una reacción positiva en el 40% de las muestras de sangre extraídas en 2019, antes de la difusión del covid-19, que se utilizaron en el estudio como control. Es decir, hubo una respuesta celular de inmunidad a los péptidos –fragmentos de proteínas– que se asemejaban a los péptidos del nuevo coronavirus en la sangre de individuos que nunca habían tenido contacto con el virus.
“La única manera de explicar esto es que esas células T de memoria en esos individuos aparecieron luego de un contacto con un patógeno muy similar”, dice Cunha-Neto. “Ese patógeno existe: es el coronavirus endémico o estacional, que ocasiona un resfrío leve”. Según el investigador, aproximadamente el 50% de la secuencia de las proteínas de los coronavirus endémicos es idéntica a la del Sars-CoV-2. “El trabajo de la Universidad de Estrasburgo ya había registrado una reactividad intensa y frecuente a los coronavirus endémicos en todos los familiares que contrajeron el covid-19 y en el 80% de las personas sanas testeadas”, dice Cunha-Neto.
En un comentario publicado el 7 de julio en la revista Nature Reviews Immunology, los científicos Alessandro Sette y Shane Crotty, coautores del artículo de la revista Cell, sostienen que más del 90% de la población humana es seropositiva para al menos tres de los cuatro tipos de coronavirus endémicos que circulan en el mundo y que la respuesta cruzada de los linfocitos T de memoria sería capaz de interferir en los resultados de la vacunación, lo que podría conducir, por ejemplo, a una respuesta inmunológica mejor o más rápida. Por otro lado, los investigadores señalan que esto puede ser un factor de confusión, especialmente para los ensayos de la fase I del desarrollo de vacunas. Sucede que las pruebas de esa fase se realizan con grupos pequeños de personas y el mero hecho de que esos individuos posean o no células de memoria a partir del contacto con coronavirus endémicos podría llevar a conclusiones distintas.
Para tratar de evitar la respuesta cruzada y constatar si efectivamente existe una inmunidad celular específica y eficaz al nuevo coronavirus, Cunha-Neto y su grupo de investigación están preparando un experimento en el cual seleccionarán los péptidos que utilizarán para verificar la respuesta celular, separando las partes que son exclusivas del Sars-CoV-2 de los tramos idénticos a los de otros coronavirus. “Solo así podremos definir si realmente hay pacientes con covid-19 seronegativos y con respuesta celular específica para el Sars-CoV-2 y cuál es su proporción”, dice el investigador. Si esto se comprueba, podría indicar que las evaluaciones de infectados/inmunes utilizando solamente pruebas de anticuerpos subestiman la cifra real de infectados con el patógeno, sostiene Cunha-Neto.
“Mientras que la producción de grandes cantidades de anticuerpos ocurre solamente antes de la eliminación del virus, y posteriormente sus niveles en sangre disminuyen o incluso se hacen indetectables, las células T de memoria perduran por décadas”, dice. Y a su vez explica que los pacientes que hace casi 20 años contrajeron el Síndrome Respiratorio Agudo Grave (Sars), una enfermedad causada por el Sars-CoV-1, “un primo” del Sars-CoV-2, poseen pocos anticuerpos, pero cantidades considerables de linfocitos T de memoria correspondiente al virus original, que se activan vigorosamente ante un nuevo contacto con el antígeno. “Ahora se cree que la memoria y la defensa a largo plazo contra el Sars-CoV-2 dependen, en gran medida, de los linfocitos T. Por eso, una vacuna eficaz tendría que estimular la producción tanto de anticuerpos neutralizantes o no neutralizantes como de linfocitos T colaboradores (CD4+) y citotóxicos (CD8+)”.
También en el InCor, Kalil desarrolla una investigación con 220 convalecientes que tuvieron la enfermedad y derrotaron al virus. Estudia la respuesta de los anticuerpos y de los linfocitos T con el propósito de definir los blancos específicos para el desarrollo de una vacuna brasileña. “Probablemente trabajaremos en nuestro agente inmunizante a partir de partículas similares al virus, denominadas VLP. Estamos estudiando para ver qué podría inducir una mejor memoria inmunológica”, dice el especialista. “No queremos utilizar la proteína entera de la espícula viral [las proyecciones que revisten al patógeno], sino extraer fragmentos para provocar una respuesta equilibrada de las células de defensa T y B, que producen anticuerpos”. Con algo de suerte y mucho trabajo, esta será una pieza más para ayudar a montar el rompecabezas de la inmunidad contra el nuevo coronavirus.
Entienda cómo reacciona el organismo cuando lo ataca un patógeno desconocido
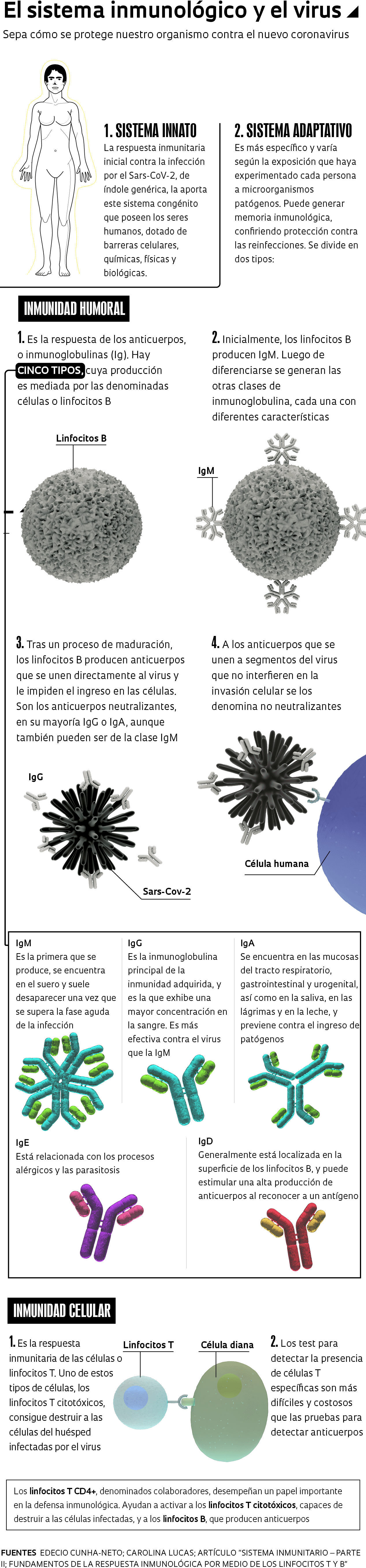
La respuesta inicial del sistema inmunológico contra la infección por el Sars-CoV-2, así como por otros nuevos virus o bacterias, surge a partir de lo que se denomina inmunidad innata o natural, que es más genérica y cada ser humano la tiene desde su nacimiento. “Si algún individuo posee una respuesta innata muy fuerte y elimina el virus, ni siquiera conservará vestigios de la infección”, dice el inmunólogo Edecio Cunha-Neto, del Instituto del Corazón (InCor).
Cuando la inmunidad natural no aniquila al patógeno en pocos días, el organismo activa lo que se denomina inmunidad adaptativa, que es más específica y varía según las experiencias del individuo con los microorganismos patógenos, generando una memoria inmunitaria. La inmunidad adaptativa involucra tanto a los anticuerpos producidos por las células o linfocitos B –lo que se denomina inmunidad humoral– como a los linfocitos T, que constituyen la inmunidad celular. Las primeras células que se activan cuando la inmunidad innata no resuelve el problema son las células T CD4+. “Cuando ocurre eso, estas actúan directamente sobre el patógeno, activan a las células T CD8+ citotóxicas, o bien a los linfocitos B”, dice Cunha-Neto.
Los linfocitos T citotóxicos CD8+ activados por los linfocitos T colaboradores CD4+ se vuelven capaces de destruir a las células infectadas por el patógeno, mientras que los anticuerpos neutralizantes impiden la entrada del virus en las células sanas. “En la mayoría de los casos, antes de tener un anticuerpo específico contra el virus se tiene una célula T específica”, explica el investigador del InCor. A veces, el virus puede ser eliminado antes de que se lleguen a producir anticuerpos, que tardan aproximadamente entre 7 y 14 días en aparecer.
Los anticuerpos del tipo inmunoglobulina M (IgM) se producen en la fase aguda de la infección y los del tipo inmunoglobulina G (IgG) aparecen después, cuando, en teoría, el paciente ya estaría protegido. Para cada patógeno diferente que ataca al organismo se producen anticuerpos (IgG, IgM, etc.) específicos para cada invasor. También existen otras tres clases de inmunoglobulina: IgA, IgE e IgD (vea la infografía en la página 30).
Según el tipo de virus, los niveles de IgG se mantienen detectables durante meses o años. Pero aparentemente eso no es lo que está ocurriendo en el caso del Sars-CoV-2, e incluso algunos estudios apuntaron que los mismos podrían desaparecer en dos o tres semanas.
En un artículo que aún no ha sido revisado por pares depositado en junio en la plataforma medRxiv, científicos de la Universidad Yale, en Estados Unidos, describen los resultados obtenidos en un estudio longitudinal en el cual realizaron un seguimiento de 103 pacientes positivos para covid-19 y los compararon con 108 individuos con test negativo para la enfermedad tomados como grupo de control, registrando la respuesta inmunológica al virus y la evolución clínica de cada uno.
Las dos conclusiones principales indican que un cuadro clínico más grave está asociado no solo a una carga viral más potente y persistente, sino también a una disfunción en la respuesta inmunológica, que en primera instancia es más lenta para controlar al Sars-CoV-2 y luego acaba desencadenando una respuesta inflamatoria exacerbada; y que hay marcadores inmunitarios presentes en la sangre desde la fase inicial de la enfermedad, capaces de predecir su evolución clínica.
“Esto podría ser de ayuda para encauzar el tratamiento y decidir intervenciones clínicas”, dice la inmunóloga brasileña Carolina Lucas, la autora principal del artículo, que actualmente realiza un posdoctorado en Yale. “Este estudio demuestra que no solo es importante enfocarse en el control del virus, sino también en el control de la respuesta inflamatoria excesiva”.
Proyectos
1. Estudio de cohorte prospectiva para el análisis de los aspectos clínicos, virales y de respuesta del huésped en pacientes con covid-19 (nº 20/05110-2); Modalidad Ayuda a la Investigación – Regular; Investigador responsable Reinaldo Salomão (Unifesp); Inversión R$ 143.100,20
2. INCT 2014: Investigación en inmunología (nº 14/50890-5); Modalidad Proyecto Temático; Investigador responsable Jorge Elias Kalil Filho (USP); Inversión R$ 3.980.221,36
3. Desarrollo de una vacuna anti-Sars-CoV-2 utilizando VLPs (nº 20/05146-7); Modalidad Ayuda a la Investigación – Regular; Investigador responsable Gustavo Cabral de Miranda (USP); Inversión R$ 178.100,00.
4. Mapeo de epítopos del virus Sars-CoV-2 para linfocitos T y del receptor de la proteína spike para linfocitos B (nº 20/05256-7); Modalidad Ayuda a la Investigación – Regular; Investigador responsable Jorge Elias Kalil Filho (USP); Inversión R$ 154.865,00.
Artículos científicos
LONG, Q. et al. Clinical and immunological assessment of asymptomatic Sars-CoV-2 infections. Nature Medicine. 18 jun. 2020.
SEOW, J. et al. Longitudinal evaluation and decline of antibody responses in Sars-CoV-2 infection. medRxiv (preprint). 11 jul. 2020.
GALLAIS, F. et al. Intrafamilial exposure to Sars-CoV-2 induces cellular immune response without seroconversion. medRxiv (preprint). 22 jun. 2020.
SEKINE, T. et al. Robust T cell immunity in convalescent individuals with asymptomatic or mild Covid-19. bioRxiv (preprint). 29 jun. 2020.
GRIFFONE, A. et al. Targets of T cell responses to Sars-CoV-2 coronavirus in humans with Covid-19 disease and unexposed individuals. Cell. 14 may. 2020.
LUCAS, C. et al. Longitudinal immunological analyses reveal inflammatory misfiring in severe Covid-19 patients. medRxiv (preprint). 27 jun. 2020.