La caducidad de una norma que permitía la extensión de los plazos de explotación de las patentes farmacéuticas en Brasil se traducirá, de acuerdo con las proyecciones elaboradas por investigadores del Instituto de Economía de la Universidad Federal de Río de Janeiro (IE-UFRJ), en un ahorro multimillonario para el Sistema Único de Salud (SUS), la red sanitaria pública nacional. El grupo analizó los precios y los volúmenes de compra de nueve medicamentos entre 2014 y 2018 en los registros del Departamento de Logística de la Salud (DLOG), dependiente de la Secretaría Ejecutiva del Ministerio de Salud. Con base en esos datos, se estimó para los próximos años un gasto de algo más de 6.800 millones de reales en esos remedios si el período de vigencia de sus patentes siguiera prorrogándose. “La posibilidad de compra de los medicamentos genéricos disponibles en el mercado internacional reduciría ese monto en 1.200 millones de reales”, destaca la economista Julia Paranhos, docente del IE-UFRJ y una de las autoras del estudio, que salió publicado en la revista Cadernos de Saúde Pública. Según la especialista, teniendo en cuenta las mayores reducciones –hay casos de genéricos que se comercializan a valores un 99 % más barato en el mercado externo–, el ahorro potencial en los gastos del SUS podría llegar a ser de 3.900 millones de reales.
Las patentes garantizan a sus titulares el derecho de comercialización exclusivo de un fármaco por un lapso de 20 años, contados a partir de la fecha de su registro en el Instituto Nacional de la Propiedad Industrial (Inpi) de Brasil. No obstante, el párrafo único del artículo 40 de la Ley de Propiedad Industrial (LPI), que data de 1996, establecía que, si la autarquía tardaba más de 10 años en conceder la patente, esta demora debía compensarse extendiendo su vigencia. Paranhos explica que, hasta 1996, el Inpi no tenía experiencia en la evaluación de patentes farmacéuticas. Tras la promulgación anticipada de la LPI, hubo que estructurar un área específica con esa finalidad, mientras el organismo ya recibía las solicitudes. “Se sabía que este proceso tendría un impacto en el plazo de análisis de los pedidos, de modo que se resolvió incorporar ese párrafo único en el artículo 40 de la ley para compensar la demora”, explica. El caso es que este privilegio posterga el ingreso de competidores, dado que la producción de copias de medicamentos de referencia solo se permite una vez transcurrido el período de protección. Esto le otorga poder de mercado a los titulares, que pueden comercializar sus productos a precios más altos, generando un impacto en el presupuesto de la salud pública y privada.
El economista Eduardo Mercadante, estudiante de doctorado en la Escuela de Economía y Ciencia Política de Londres (LSE, por sus siglas en inglés), en el Reino Unido, informa que los depósitos de patentes farmacéuticas tardan en promedio 13 años en recibir una resolución final para su concesión en Brasil, “y eso tiene una consecuencia directa en el plazo de vigencia de las patentes, porque hace que el párrafo único del artículo 40 sea la regla, y no una excepción, como estaba previsto inicialmente”, dice el investigador, uno de los autores del estudio. “Esto es particularmente problemático en un país como el nuestro, con una fuerte dependencia tecnológica y un gran sistema público de salud”, añade Paranhos.
Entre 2014 y 2018, el DLOG erogó 10.600 millones de reales para la compra de los nueve medicamentos evaluados por los economistas. “Es sorprendente que unos pocos medicamentos puedan generar semejante presión fiscal en el presupuesto del SUS”, comenta el economista. El anticuerpo monoclonal adalimumab, que se utiliza para el tratamiento de la artritis reumatoide, la psoriasis y enfermedades inflamatorias intestinales, fue el que más impacto tuvo en las arcas públicas. Su costo total de compra en el período fue de aproximadamente 3.800 millones de reales. Otro medicamento caro fue el eculizumab, que se utiliza en el tratamiento de la hemoglobinuria paroxística nocturna, un tipo raro de anemia que puede causar enfermedad renal crónica e hipertensión pulmonar, entre otros efectos. Se calcula que el gobierno gastó algo más de 2.300 millones de reales en su adquisición.

Al menos tres estudios más, basados en metodologías diferentes, también habían proyectado las repercusiones de la extensión de la vigencia de las patentes en el presupuesto del SUS. Uno de ellos, elaborado en 2016 por el propio grupo del IE-UFRJ, estimó el costo adicional vinculado a la compra de otros nueve fármacos con sus patentes con vigencia extendida en 2.100 millones de reales. Dos de estos medicamentos coinciden con los de la lista de la investigación más reciente de Paranhos y Mercadante: el sofosbuvir, que se utiliza contra la hepatitis crónica, y el adalimumab. En tanto, una investigación de 2017 también publicada en la revista Cadernos de Saúde Pública por investigadores del Inpi y del Instituto Nacional de Tecnología (INT), de Río de Janeiro, estipuló un costo potencial adicional de 288,4 millones de reales en tres antirretrovirales que se emplean contra las infecciones causadas por el VIH. Y recientemente, una auditoría realizada por el Tribunal de Cuentas de la Unión (TCU) analizó 11 compuestos adquiridos entre 2010 y 2019. Según los auditores, el SUS podría haberse ahorrado unos 1.000 millones de reales si la vigencia de las patentes no se hubiese ampliado.
Este impacto podría ser menor, ya que el Ministerio de Salud tiene la prerrogativa de solicitarle al Inpi el análisis prioritario de las patentes de los medicamentos que forman parte de las políticas asistenciales o la de aquellos considerados estratégicos. Esto aceleraría la conclusión de los procesos y evitaría la explotación exclusiva de los fármacos por un lapso superior a 20 años. Empero, según el informe del TCU, el ministerio tan solo hizo uso de esa prerrogativa en 16 oportunidades desde 2008, cuando la normativa entró en vigencia. Se estima que al menos 74 medicamentos fueron beneficiados con la prórroga.
En 2021, el Supremo Tribunal Federal (STF) le puso fin al problema, cuando por 9 votos a 2, declaró la inconstitucionalidad del párrafo único del artículo 40 de la LPI. “La resolución tiene efectos retroactivos”, aclara el abogado Pedro Marcos Nunes Barbosa, docente del Departamento de Derecho de la Pontificia Universidad Católica de Río de Janeiro (PUC-RJ). “Todas las patentes con aplicación potencial en el área de la salud cuyo plazo de vigencia haya sido ampliado –incluso aquellas aún en análisis y que podrían beneficiarse de la disposición de la LPI en el futuro– perdieron dicho privilegio”.
Algunas empresas farmacéuticas están tratando de eludir la resolución del STF mediante demandas presentadas ante la Justicia Federal de Brasilia. “Admiten que no existe una normativa legal para la extensión de la vigencia de las patentes en Brasil, pero como esto existe en otros países y el Inpi tiene un déficit estructural para analizar los depósitos, intentan aplicar, por analogía, una norma legal aprobada por los Congresos de países extranjeros para postergar el dominio público de sus patentes aquí”, explica.
El presupuesto del INPI para gastos e inversiones cayó de 80,1 millones a tan solo 34 millones de reales en los últimos cinco años
Hay más de 30 demandas judiciales de este tipo en curso en el país. Al menos dos de ellas, señala Barbosa, obtuvieron medidas cautelares a favor de los propietarios de las patentes. “Hasta ahora ninguna ha conseguido una sentencia favorable, pero bastaría que una lo logre para generar inseguridad en el mercado, ya que habrá otras empresas que utilicen la misma estrategia para retrasar el dominio público de sus patentes e inhibir el ingreso de competidores”, dice el abogado, quien explica que las empresas tardan mucho tiempo e invierten gran cantidad de dinero preparándose para el lanzamiento de sus genéricos y biosimilares tan pronto como la patente del medicamento de referencia pasa a ser de dominio público. “Para ello deben presentar datos sobre la calidad, la seguridad y la eficacia a Anvisa [la Agencia Nacional de Vigilancia Sanitaria], para obtener el registro sanitario, algo que puede tardar meses, e incluso años”. Según Barbosa, esta planificación resulta inviable en un escenario de incertidumbre sobre el plazo de duración del monopolio.
A pesar del impacto positivo en el presupuesto del SUS, algunos expertos sostienen que la resolución del STF no ataca la causa del problema: la histórica demora del Inpi para evaluar los pedidos de patentes. “Sus condiciones de funcionamiento siguen estando por debajo del nivel de los grandes despachos internacionales”, comenta el abogado Matheus Ferreira Bezerra, docente de la Universidad del Estado de Bahía (Uneb). En un estudio reciente, el economista Eduardo Mercadante analizó los procesos de patentamiento en Brasil, específicamente los respectivos al sector farmacéutico. Comparó la situación del Inpi con la de las cinco mayores oficinas del mundo –Estados Unidos, China, Japón, Corea del Sur y Europa–, además de la India y México. Y comprobó que Brasil está entre los que menos solicitudes de patentes reciben por año –solamente por delante de México–, pero es el que más demora para expedirse al respecto.
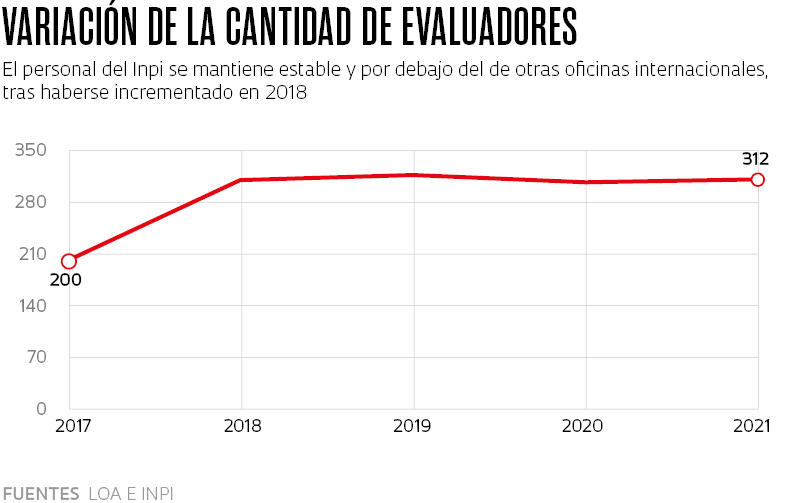
A juicio de Mercadante, este problema se debe principalmente al bajo número de examinadores. En 2019 eran 318, mientras que China tenía más de 12.000 y Estados Unidos más de 8.000”, informa. Por entonces, cada evaluador del Inpi tenía 641 solicitudes en espera –el promedio internacional es de 112 por examinador. “Los pedidos de patente tardan siete años, en promedio, en comenzar a ser evaluados, pero el examen en sí, demora unos tres años y medio”.
La situación ha empeorado en los últimos años. Desde 2019, los evaluadores del Inpi se han reducido a 312. “Sencillamente no dan abasto con la cantidad de solicitudes”, añade el economista. Para Bezerra, “esta morosidad puede desalentar el registro de nuevos fármacos en Brasil”. En ese sentido, Elize Massard da Fonseca, experta en salud pública y docente de la Fundación Getulio Vargas (FGV) de São Paulo, no cree que el país vaya a experimentar un retroceso. “El retraso en la concesión de patentes podría generar cierto desinterés, pero a nivel mundial, Brasil es el sexto mercado farmacéutico y seguirá siendo atractivo para las grandes empresas”.
Entre 2013 y 2021, la cifra de patentes nacionales y extranjeras depositadas anualmente en el Inpi descendió de 34.000 a 26.900, según datos de la Organización Mundial de la Propiedad Intelectual divulgados recientemente por la Asociación Brasileña de la Propiedad Intelectual (ABPI). Por el contrario, en el mundo, el total de solicitudes ha crecido de 2,57 a 3,22 millones.
En agosto de 2019, el Inpi puso en marcha un plan para disminuir el número de patentes pendientes de resolución. La estrategia consiste en analizar las solicitudes presentadas hasta 2016 tomando como base los dictámenes anteriores emitidos por las oficinas de patentes extranjeras; la mayoría de los depósitos realizados en Brasil poseen análogos en otros países, ya que el 70,5 % procede de instituciones del exterior. La idea, según Alexandre Dantas, asistente de la Dirección de Patentes, Programas Informáticos y Topografías de Circuitos Integrados del Inpi, es acelerar el proceso de evaluación técnica y reducir el tiempo de espera para el dictamen final. “Hemos simplificado los análisis solicitando al depositante que adecúe su solicitud a la versión aprobada por la oficina internacional”, dice. La autarquía tenía casi 149.900 solicitudes acumuladas. Se estima que esta estrategia habrá reducido ese cúmulo en un 76,8 % para 2021, sin embargo, según Mercadante, este porcentaje solamente se refiere a los pedidos que podían incluirse en el plan hasta agosto de 2019, y no tiene en cuenta muchos otros que se encuentran en espera desde entonces. “Mis cálculos indican que esa reducción ha sido de un 28 %”, considera.
El Inpi informa que ha logrado reducir el tiempo promedio del análisis inicial a 2,4 años, contados a partir de la fecha de depósito del pedido. Esto ha acelerado el plazo para el dictamen final, que en 2022 es de 5,8 años en las áreas de fármacos y biofármacos, contados a partir de la solicitud de su evaluación técnica. Según Dantas, esta reducción, en parte ha sido posible porque las solicitudes ya no se envían a Anvisa para que las analice. Hasta entonces, la agencia debía emitir un dictamen de consentimiento previo para la concesión de patentes de esa naturaleza. “Con la revocación de dicha disposición hemos acelerado los trámites”. No obstante, según Mercadante, es importante que Anvisa siga participando del proceso, y añade: “La estrategia adoptada por el Inpi es menos eficiente de lo que aparenta, ya que restringe la autonomía de los evaluadores, concede más pedidos de los que debería y permite que se protejan invenciones de menor calidad”.
De cualquier modo, el Inpi afrontará dificultades para sostener un ritmo de análisis más ágil. En los últimos cinco años, el monto disponible en su presupuesto para gastos e inversiones ha disminuido progresivamente, pasando de 80,1 millones de reales en 2018 a tan solo 34 millones en 2022. Al mismo tiempo, la cuota bloqueada como reserva para imprevistos aumentó de 258,5 a 371,5 millones de reales. “La contratación y la capacitación de examinadores son esenciales para el funcionamiento del organismo, subraya Bezerra. No menos importante, según Paranhos, es la efectividad de su autonomía financiera y administrativa “prevista en el marco de la ley de creación del Inpi y en la LPI, que aún está lejos de ser una realidad”.
Artículos científicos
MERCADANTE E. & Paranhos J. Pharmaceutical patent term extension and patent prosecution in Brazil (1997-2018). Cadernos de Saúde Pública. v. 38, n. 1, p. 1-13. 2022.
PARANHOS J., Mercadante E. & Hasenclever L. O custo da extensão da vigência de patentes de medicamentos para o Sistema Único de Saúde. Cadernos de Saúde Pública. v. 36, n. 11, p. 1-13. 2020.


