El laboratorio del fisiólogo José Donato Junior, del Instituto de Ciencias Biomédicas de la Universidad de São Paulo (ICB-USP), alberga un “hotel de ratitas” con una impresionante diversidad de animales. En total, él y su equipo vigilan de cerca a 1.200 roedores de más de 40 familias y miden los hábitos y rutinas de cada uno. Entre todos los grupos, uno se destaca sobre el resto: el de los ratones gordos. No es casualidad ni se debe a dietas especiales que estos animales tripliquen el peso de un ratón normal. Los roedores obesos presentan una alteración genética que les impide producir una hormona que le indica al cerebro cuándo debe deje de comer. Sin esta hormona inductora de la saciedad, ingieren más comida de la debida y engordan. El efecto producido por esta mutación simula un fenómeno que ha empezado a comprenderse mejor en los últimos años y que podría explicar, al menos en parte, por qué algunos grupos de roedores – y quizá también de seres humanos – son más propensos a desarrollar obesidad y diabetes: la programación metabólica.
Este concepto sugiere que el ambiente al que se expone a las crías durante la gestación y poco después del nacimiento influye en el desarrollo de ciertas áreas cerebrales, como las responsables de controlar el hambre y la saciedad, y favorece la aparición de enfermedades una vez que se convierten en adultos. En un artículo de revisión publicado en abril en la revista Nature Reviews Endocrinology, Donato analizó 161 estudios sobre el tema y consolidó las pruebas de cómo este fenómeno está relacionado con el desarrollo de la obesidad y la diabetes. “La búsqueda de la comprensión de este concepto es importante porque las enfermedades cardiovasculares, que tienen como factores de riesgo la obesidad y la diabetes, son las principales causas de muerte a nivel mundial”, dice el fisiólogo.
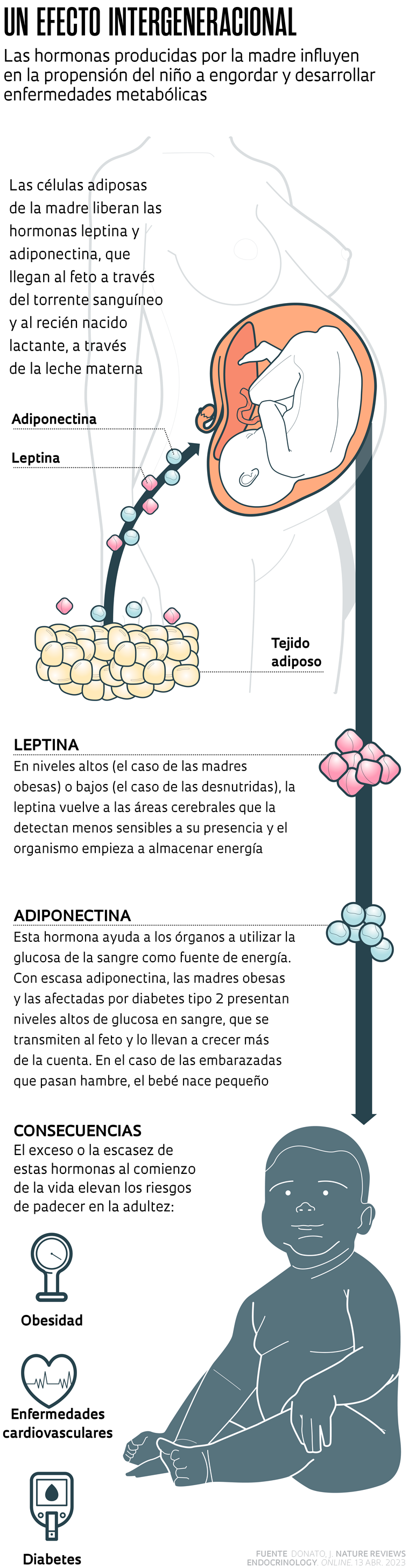
Estos estudios, que incluyen datos experimentales obtenidos con roedores y observaciones en humanos, indican que, al menos en el caso de la diabetes y la obesidad, la programación metabólica tiene lugar a través de la liberación por parte del organismo materno de un grupo de compuestos químicos denominados adipoquinas. Producidas por las células del tejido adiposo, las adipoquinas funcionan como hormonas. A través del torrente sanguíneo, llegan al cerebro del feto e influyen en la formación de áreas vinculadas a la regulación del hambre, la saciedad y el gasto energético. Tras el nacimiento, siguen modulando la maduración de estas áreas cerebrales y otros tejidos corporales al ser transferidas a la descendencia a través de la leche materna o producidas por los propios recién nacidos.
En ambas situaciones, pueden actuar tanto a nivel celular como molecular. En el primer caso, las adipoquinas modifican las conexiones entre las células, alterando la estructura de los circuitos cerebrales. En el segundo, mediante mecanismos epigenéticos, activan o desactivan genes importantes para el funcionamiento de estas células. “Las enfermedades metabólicas también pueden ser causadas por marcas epigenéticas, que se forman a lo largo de la vida y se transmiten de generación en generación”, comenta la bióloga Patrícia Boer, investigadora de la Universidad de Campinas (Unicamp) y presidenta de DOHaD Brasil (Orígenes del Desarrollo de la Salud y la Enfermedad).
De las casi 10 adipoquinas identificadas, se sabe que dos – la leptina y la adiponectina – cumplen un papel fundamental en la programación metabólica que puede conducir a la obesidad y la diabetes. La leptina, identificada en 1994, es una de las hormonas que regulan el hambre y la saciedad en los seres humanos desde la infancia. Señala al cerebro cuándo el cuerpo ha comido lo suficiente y está listo para gastar la energía que ha acumulado. Curiosamente, las personas obesas producen niveles más altos de leptina. Esto se debe a que el cerebro pierde su sensibilidad a la acción de esta hormona, lo que se denomina resistencia a la leptina. Como resultado, las personas obesas comen más de lo que deberían y gastan menos la energía almacenada, generando una reserva que se convierte en grasa. Es algo muy parecido a lo que ocurre con la insulina en los casos de diabetes tipo 2.
Sin embargo, durante el desarrollo del feto, esta hormona actúa de dos maneras. Cuando la gestante es obesa, su organismo produce mucha leptina, que llega al feto en niveles elevados. Expuestas a demasiada leptina, las regiones cerebrales que deberían percibir la presencia de esta hormona se vuelven insensibles a ella. En principio, este organismo estaría programado para ser resistente a la leptina y, en consecuencia, almacenar más energía en forma de grasa y desarrollar potencialmente enfermedades metabólicas como la obesidad y la diabetes. Por su parte, los hijos de madres con un peso inferior al ideal están menos expuestos a la leptina durante el embarazo y sus cerebros no aprenden a identificar la acción de la hormona. Es como si esta hormona no existiera para ellos, lo mismo que sucede con los ratones obesos del laboratorio de Donato. Tanto los hijos de madres obesas como los de madres más delgadas de lo ideal presentan la misma propensión a volverse obesos y a padecer diabetes en el curso de sus vidas.
Lo que les ocurre a los roedores nacidos de madres muy delgadas trae a la memoria de la bioquímica Cristiane Matté, de la Universidad Federal de Rio Grande do Sul (UFRGS), un estudio de seguimiento poblacional de los descendientes de las embarazadas neerlandesas que padecieron hambrunas durante la invasión nazi de 1944. El grupo, coordinado por la epidemióloga Tessa Roseboom, de la Universidad de Ámsterdam, observó que las restricciones alimentarias de las madres afectaban de manera permanente la estructura orgánica de sus hijos, quienes, de adultos, desarrollaron problemas renales, respiratorios, de salud mental y metabólicos, especialmente obesidad. Este efecto pasó de generación en generación, repercutiendo en la salud pública del país durante décadas, según informaron los investigadores en un artículo publicado en 2021 en la revista BMJ Open.
“Las madres que tuvieron un aporte nutricional extremadamente restringido durante el tercer trimestre del embarazo dieron a luz a niños con un fenotipo económico”, explica Matté, investigadora del Centro de Estudios en Programación Metabólica de la UFRGS y miembro de la Asociación DOHaD Brasil. “Cuando estos niños nacieron, la guerra ya había pasado, pero su metabolismo estaba programado para un entorno de escasez y para aprovechar al máximo los hidratos de carbono, lípidos y proteínas a los que podían acceder”.
El concepto de fenotipo económico fue acuñado por el epidemiólogo británico David Barker (1938-2013) tras observar que los niños que nacían con un peso inferior al deseable morían más tarde debido a enfermedades cardiovasculares causadas por otros trastornos metabólicos. Estudios posteriores con roedores revelaron que la exposición a bajos niveles de leptina durante el embarazo o poco después del nacimiento, una situación análoga a la que viven los hijos de madres que han padecido severas privaciones alimentarias, genera alteraciones que propician la aparición de diabetes y obesidad en la adultez.
La otra hormona destacada por Donato en el artículo de Nature Reviews Epidemiology es la adiponectina, que programa al metabolismo del feto de una forma diferente. En lugar de influir en el desarrollo del cerebro, como la leptina, la adiponectina actúa sobre el acceso a los nutrientes y repercute en el tamaño del bebé al nacer. Aumenta la sensibilidad de las células hepáticas y musculares a la hormona insulina, responsable de la utilización de la glucosa como fuente de energía.
Las mujeres embarazadas con diabetes suelen tener niveles bajos de adiponectina en sangre y, en consecuencia, concentraciones elevadas de glucosa. Al disponer de más nutrientes, sus bebés nacen más grandes de lo esperado para su edad gestacional. Con las embarazadas que pasan hambre ocurre lo contrario. Sus niveles de adiponectina en sangre son altos y los de glucosa, bajos. Al tener menos acceso a este nutriente, el feto se desarrolla menos y el bebé nace con un peso inferior al considerado saludable. En ambas situaciones, sin embargo, el resultado es similar: hay un aumento significativo del riesgo de desarrollar obesidad, diabetes y enfermedades cardiovasculares en la adultez. Barker fue el primero en establecer esta asociación –la llamada hipótesis de Barker– entre la talla del bebé al nacer y el riesgo de desarrollar estas enfermedades. “Las alteraciones del crecimiento fetal son importantes para incrementar o disminuir el riesgo de enfermedades más adelante”, sostiene Donato. En varios países puede accederse fácilmente a los datos sobre el tamaño de los bebés al nacer, lo que ha permitido investigar más a fondo esta relación.

Léo Ramos Chaves / Revista Pesquisa FAPESPEl “Hotel de ratitas” del ICB-USP, donde los investigadores realizan un seguimiento sobre más de 40 familias de roedoresLéo Ramos Chaves / Revista Pesquisa FAPESP
Los experimentos realizados con roedores en laboratorios como el de Donato ayudan a comprender lo que ocurre en el organismo humano. “Sabemos que toda la fisiología de la leptina es idéntica en personas y animales”, dice el investigador. Una ventaja de los estudios con roedores es que la gestación tan solo dura 21 días, lo que permite observar en pocos días o semanas lo que en los humanos puede tardar años en suceder.
Este conocimiento puede ser útil para informar a la población que las enfermedades metabólicas durante el embarazo pueden ser tan perjudiciales para el feto como beber o fumar. “Esto no es tan obvio para la población y saberlo les permite a los padres planificar la pérdida de peso y el control de la diabetes antes de tener un hijo”, añade Donato. “Es muy importante ser más rigurosos en el control del peso y la nutrición durante la atención prenatal”. A largo plazo, cabe esperar que los estudios inspiren nuevas terapias para evitar que los bebés se conviertan en adultos con enfermedades metabólicas.
Aunque puede explicar parte de los casos de obesidad y diabetes en la vida adulta, la programación metabólica no debe considerarse como una sentencia definitiva al respecto de la salud futura. Estas enfermedades son multifactoriales. Pueden deberse a influencias externas, pero también a la herencia genética o epigenética. “Si las causas fueran exclusivamente genéticas, tan solo el 5 % de la población sería obesa, por ejemplo, pero el porcentaje es mucho mayor”, dice el endocrinólogo Lício Velloso, profesor de medicina en la Unicamp. El acceso a una alimentación de calidad también influye en la aparición de enfermedades metabólicas y debería ser fomentado por las políticas públicas y los profesionales de la salud, especialmente en el caso de las mujeres embarazadas, sostienen los investigadores.
No obstante, la programación metabólica no siempre tiene consecuencias negativas. “En estudios que se llevaron a cabo con roedores, las hembras que habitualmente hacían ejercicios mientras estaban preñadas parían crías que también practicaban más actividad física”, relata Matté, de la UFRGS, “En otras palabras, el ejercicio puede dejar huellas de por vida”. En estos casos, se trataría de una ‘programación metabólica beneficiosa’”.
En el caso de los humanos, los investigadores estiman que la programación metabólica puede tener lugar al menos hasta el segundo año de vida. “Los primeros mil días de desarrollo, que comienzan con la concepción y se extienden hasta el segundo año de vida constituyen efectivamente el período de mayor plasticidad y de adaptación metabólica de los órganos a las influencias del medio externo”, explica la investigadora. “Todo lo que ocurre durante este periodo repercute en la salud del individuo a lo largo de toda su vida”, concluye Matté.
Proyectos
1. El sistema nervioso central como blanco de la hormona del crecimiento para la regulación de múltiples funciones biológicas (nº 20/01318-8); Modalidad Proyecto Temático; Investigador responsable José Donato Junior (ICB-USP); Inversión R$ 1.616.023,74.
2. CMPO – Centro Multidisciplinario de Investigaciones en Obesidad y Enfermedades Asociadas (nº 13/07607-8); Modalidad Centros de Investigación, Innovación y Difusión (Cepid); Investigador responsable Licio Augusto Velloso (Unicamp); Inversión R$ 28.596.577,04.
Artículos científicos
DONATO, J. Programming of metabolism by adipokines during development. Nature Reviews Endocrinology. Online. 13 abr. 2023.
BLECKER, L. S. et al. Cohort profile: The dutch famine birth cohort (DFBC) ‒ A prospective birth cohort study in the Netherlands. British Medical Journal Open. Online. 04 mar. 2021.
Republicar