A medida que envejecen, los monos capuchinos robustos, que se encuentran entre los primates más inteligentes de América, pueden presentar en el cerebro los mismos tipos de lesiones que caracterizan a la enfermedad de Alzheimer. Investigadores de la Facultad de Medicina de la Universidad de São Paulo (FM-USP) y del Centro de Primatología de la Universidad de Brasilia (UnB) identificaron en dos ejemplares ancianos de la especie ‒ uno de 29 y otro de 33 años ‒ placas de péptidos beta-amiloides, formadas por la acumulación de estos fragmentos proteicos alrededor de las neuronas, como así también enmarañados neurofibrilares de proteína tau, que se concentran en el interior de estas células y las matan. Ni las placas ni los enmarañados se encontraron en el cerebro de un ejemplar adulto joven, de 9 años. Estos hallazgos se publicaron en marzo en la revista Scientific Reports y, según los autores, podrían allanar el camino para que los monos capuchinos robustos sean adoptados como modelo natural para estudiar la evolución y el tratamiento del alzhéimer, el tipo de demencia más común en los seres humanos (lea en Pesquisa FAPESP, edición nº 329).
La idea de ver si en los monos capuchinos robustos ocurría algo similar al alzhéimer había surgido años atrás, cuando el neurólogo Ricardo Nitrini, de la FM-USP, estudioso de la epidemiología de las demencias en Brasil y uno de los coordinadores de la investigación, conoció a la psicóloga Maria Clotilde Tavares, experta en neurociencia y conducta, quien ya coordinaba el Centro de Primatología de la UnB, en donde vivían los animales que se utilizaron en el estudio. “Aguardamos a que ellos murieran de forma natural para examinar sus tejidos cerebrales”, comenta Nitrini.
Con un tamaño variable entre 35 y 48 centímetros (sin incluir la cola) y un peso de hasta 4,8 kilogramos, los monos capuchinos robustos (Sapajus spp.), constituyen una de las especies de primates no humanos más comunes de América. En Brasil, habitan prácticamente en todos los biomas, desde los más húmedos, como la Amazonia y el Bosque Atlántico, hasta los más secos, como el Cerrado y la Caatinga. Y concitan el interés de quienes estudian el declive cognitivo porque además de ser abundantes, tienen habilidades manuales y comportamientos más sofisticados que otros monos, como el uso y la fabricación de herramientas para cazar o extraer castañas, un conocimiento que transmiten de generación en generación (lea en Pesquisa FAPESP, edición nº 259). A estas características hay que añadirles otros dos hechos: el volumen encefálico en comparación con el cuerpo ‒ el llamado cociente de encefalización, un indicador de inteligencia ‒ es superior al de la mayoría de los otros primates no humanos y su cerebro es anatómicamente más parecido al de las personas, con pliegues y surcos, que el de otras especies de monos, especialmente los nativos del continente.
“Estos animales tienen una gran plasticidad comportamental y se adaptan a distintos ambientes. Creo que a partir de este estudio van a ser más valorados en la investigación de las enfermedades neurológicas”, dice Tavares, de la UnB. “Los monos capuchinos robustos tienen una vida larga, pudiendo alcanzar los 40 años en cautiverio. Esto permitirá estudiar cómo afecta a sus habilidades la degeneración cerebral con el paso del tiempo”, comenta el primatólogo Tiago Falótico, investigador y actual presidente de la organización no gubernamental Neotropical Primates Research Group (NeoPReGo). Falótico estudia el uso de herramientas y la evolución cultural de los monos capuchinos robustos y no participó en el trabajo publicado en Scientific Reports, realizado con financiación de la FAPESP y el Consejo Nacional de Desarrollo Científico y Tecnológico (CNPq), de Brasil, y la Alzheimer’s Association y los Institutos Nacionales de Salud (NIH), de Estados Unidos.
Hasta hace algún tiempo, los neurólogos y neurocientíficos daban por sentado que el mal de Alzheimer era una enfermedad exclusivamente humana, porque no se conocían otros animales que presentaran simultáneamente ambos tipos de lesiones, típicas de la misma. Esta noción empezó a cambiar en 2008, cuando el equipo del neurocientífico Lary C. Walker, de la Universidad Emory (EE. UU.), informó en un artículo publicado en la revista The Journal of Comparative Neurology que había encontrado placas de péptidos beta-amiloides y enmarañados de proteína tau en el cerebro de un chimpancé hembra de 41 años.
Roberta Diehl Rodriguez / USPAlto cociente de encefalización: los monos capuchinos robustos poseen un cerebro (imagen real) proporcionalmente grande en comparación con su cuerpoRoberta Diehl Rodriguez / USP
Originarios de África, estos grandes simios son los primates vivos más cercanos a los seres humanos en términos evolutivos. Ambos compartieron un antepasado común hace entre 7 y 5 millones de años y tienen casi el 99 % de su genoma idéntico. Por ello, desde un punto de vista biológico, los chimpancés parecían un buen modelo para estudiar la evolución y el tratamiento de enfermedades que afectan al Homo sapiens, entre ellas la enfermedad de Alzheimer. Pero el mantenimiento de un chimpancé en laboratorio es caro ‒el costo supera los 20.000 dólares al año, según algunas estimaciones‒ y estos animales se encuentran en peligro de extinción (quedan menos de 300.000 viviendo en libertad en la naturaleza). Además, desde hace poco más de una década, las directrices de las investigaciones con animales se han endurecido (véase el artículo). Las autoridades sanitarias de Estados Unidos y Europa empezaron a recomendar que solo se utilizaran chimpancés para investigar enfermedades humanas cuando no hubiera otro modelo disponible ni fuera posible, por impedimentos éticos, la realización de pruebas en humanos.
Ante la imposibilidad de realizar ciertos experimentos en humanos, los científicos han hecho avances en la comprensión de los fenómenos que subyacen al alzhéimer y en la búsqueda de tratamientos potencialmente más eficaces a partir de estudios iniciales con modelos que no siempre son ideales. Los experimentos suelen comenzar con cultivos celulares en laboratorio, que permiten estudiar el patrón de activación de los genes y las alteraciones en las vías bioquímicas que se producen en la enfermedad, y prosiguen con pruebas en roedores, casi siempre ratones, capaces de revelar cómo afecta la enfermedad en algunos aspectos cognitivos. La diversidad de modelos que se han probado para tratar de entender cómo se instala y evoluciona la enfermedad es amplia. Abarca desde helmintos a moscas de la fruta; desde peces a otros primates, como lémures y algunas especies de monos. Sin embargo, ninguno de ellos reproduce fiel y totalmente lo que ocurre en el cerebro humano.
Los invertebrados, por ejemplo, corren con ventaja en ciertas situaciones, ya que comparten con los seres humanos algunos genes relevantes en la enfermedad de Alzheimer y se reproducen más rápidamente que los mamíferos. Empero, si bien pueden ser útiles para aprender sobre las vías bioquímicas afectadas en la enfermedad, no son los más idóneos para estudiar tratamientos porque los efectos que los compuestos producen en ellos no siempre son los que se observan en animales con un sistema nervioso más complejo.
Los roedores, por lejos los más utilizados en las investigaciones, permiten observar algunos efectos comportamentales de la enfermedad, como la pérdida de la memoria espacial, y ciertos beneficios de posibles terapias. Pero no permiten reproducir la enfermedad en todos sus aspectos. “Los ratones y las ratas no desarrollan espontáneamente placas de péptido beta-amiloide ni enmarañados de proteína tau, aunque la primera de estas lesiones aparece naturalmente en ejemplares añosos de un roedor llamado degú, que vive en Chile”, dice el bioquímico Sergio Teixeira Ferreira, de la Universidad Federal de Río de Janeiro (UFRJ), quien investiga las causas del alzhéimer.
Desde hace al menos dos décadas, los investigadores procuran sortear esta limitación manipulando artificialmente a los animales. Una de las estrategias consiste en introducir modificaciones genéticas en los roedores para que produzcan placas de beta-amiloide o enmarañados de tau. Otra, desarrollada por el grupo de la UFRJ, consiste en inyectar fragmentos (oligómeros) de péptido beta-amiloide directamente en el cerebro de los ratones. “Esto provoca alteraciones muy parecidas a las del mal de Alzheimer, incluyendo la pérdida de memoria”, explica Ferreira.
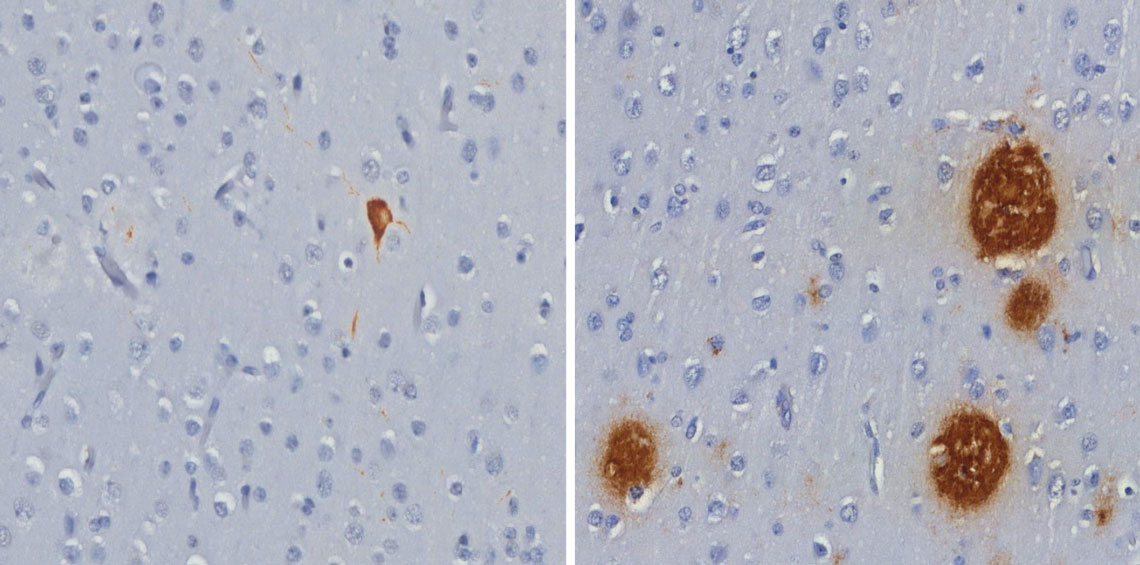
Roberta Diehl Rodriguez / USPEnmarañado de proteína tau (a la izq.) y placas de péptido beta-amiloide (a la der.), ambos en color marrón, hallados en el cerebro de monos capuchinos robustosRoberta Diehl Rodriguez / USP
De todas maneras, lo que ocurre con los roedores puede ser muy distinto a lo que acontece en el cerebro de las personas. Los ratones, por ejemplo, solo comparten el 85 % de su genoma con los seres humanos y sus cerebros son anatómicamente mucho más simples. En los roedores, el órgano tiene una proporción mayor de neuronas que de otras células, mientras que en el cerebro humano, la composición es aproximadamente de uno a uno. Esta diferencia, estiman algunos investigadores, podría hacer que la enfermedad progrese en los animales de manera distinta a como lo hace en los humanos.
“A pesar de su éxito, los modelos celulares bidimensionales y los modelos animales solo consiguen captar una parte de los mecanismos de la enfermedad de Alzheimer, porque son incapaces de reproducir la estructura, la función y la diversidad celular específicas del cerebro humano”, escribieron el bioingeniero Donghui Zhu y sus colaboradores de la Universidad Stony Brook (EE. UU.), en un artículo de revisión publicado en 2022 en la revista Bioengineering and Translational Medicine.
Una forma de acortar distancias entre la enfermedad humana y los modelos animales consiste en utilizar especies filogenéticamente más cercanas que desarrollen espontáneamente la patología típica del alzhéimer. “El trabajo con modelos naturales nos permite apreciar una imagen más realista, más parecida a lo que les ocurre a los seres humanos”, dice Analía Arévalo, neurocientífica especializada en el lenguaje e investigadora del Laboratorio de Investigaciones en Cirugía Experimental de la FM-USP, quien no participó en el estudio de Scientific Reports.
Incluso entre los primates, cuya arquitectura cerebral es más compleja que la de los roedores y evolutivamente están más cerca de los seres humanos, aún no se ha encontrado un modelo perfecto. Se han hallado placas de péptido beta-amiloide en monos Rhesus (Macaca mulatta), macacos cangrejeros (Macaca fascicularis), monos titíes comunes (Callithrix jacchus) y lémures ratón gris (Microcebus murinus), pero no siempre a la par de los enmarañados de proteína tau, aunque estos animales pueden presentar déficit cognitivo. Otra diferencia radica en las regiones cerebrales en que se forman estas placas y enmarañados. En los seres humanos, aparecen más a menudo en el hipocampo, un área asociada a la adquisición y consolidación de la memoria, mientras que en los titíes y en los monos Rhesus son más frecuentes en las zonas asociadas a las emociones (el sistema límbico) o a la audición (la corteza temporal).
En estos dos aspectos, los monos capuchinos robustos parecen proporcionar un modelo más cercano a la enfermedad humana: presentan las placas de beta-amiloides y los enmarañados de proteína tau, y estas lesiones afectaron tanto a la corteza como al hipocampo. Los científicos también han detectado en ellos signos de neuroinflamación, al igual que lo que ocurre en los humanos. “Ningún otro primate del Nuevo Mundo utilizado en los estudios es tan inteligente como el mono capuchino robusto, que fabrica sus propias herramientas y puede mantenerse en posición bípeda bastante tiempo”, dice la neurocientífica Roberta Diehl Rodriguez, autora principal del estudio en Scientific Reports. “Además, es el primate del Nuevo Mundo que presenta alteraciones neuropatológicas más similares a las de los seres humanos”, señala.
Con todo, para que los monos capuchinos robustos se conviertan efectivamente en un modelo para el estudio de la enfermedad de Alzheimer, los investigadores tendrán que verificar las lesiones en una mayor cantidad de animales y caracterizar cómo afectan su comportamiento. “Este sería el aspecto más interesante que habría que comparar con el perfil de la enfermedad en los humanos”, pondera Arévalo.
Y aunque todo ello funcione, existe una limitación. La progresión de la enfermedad en estos animales puede llevar décadas. Para superar este problema, el grupo de la neurocientífica Fernanda De Felice, de la UFRJ, busca un modelo artificial de alzhéimer en primates jóvenes. Hace 10 años, ella y sus colaboradores de la Queen’s University, en Canadá, consiguieron reproducir en el cerebro de macacos cangrejeros, también en peligro de extinción, los daños que causa el mal de Alzheimer en humanos inyectando en el cerebro de los animales oligómeros beta-amiloides, que se acumulan en la corteza frontal, en el hipocampo y en otras áreas asociadas a la memoria y a aspectos cognitivos (lea en Pesquisa FAPESP, edición nº 225). Más recientemente, el grupo indujo la aparición de las lesiones en monos Rhesus jóvenes, de entre 3 y 5 años, para no tener que esperar la evolución natural del alzhéimer. “Si logramos reproducir la enfermedad en animales jóvenes, ello facilitaría en gran medida nuestro trabajo”, dice Ferreira, de la UFRJ, marido y colaborador de Felice.
Proyecto
Caracterización de la astrogliopatía tau en el envejecimiento y en enfermedades neurodegenerativas (nº 16/24326-0); Modalidad Beca de posdoctorado; Investigador responsable Ricardo Nitrini (USP); Becaria Roberta Diehl Rodriguez; Inversión R$ 301.733,62.
Artículos científicos
RODRIGUEZ, R. D. et al. Bearded capuchin monkeys as a model for Alzheimer’s disease. Scientific Reports. 15 mar. 2024.
ROSEN, R. F. et al. Tauopathy with paired helical filaments in an aged chimpanzee. The Journal of Comparative Neurology. 14 may. 2008.
SREENIVASAMURTHY, S. et al. Current progress of cerebral organoids for modeling Alzheimer’s disease origins and mechanisms. Bioengineering and Translational Medicine. 29 jul. 2022.
