Se requirieron casi dos décadas de trabajo para desarrollar el dispositivo y las técnicas necesarias como para poder visualizar un fenómeno que químicos y físicos conocían en forma teórica o a través de simulaciones en computadora: las transformaciones estructurales en tiempo real que sufre una molécula aislada a medida que gana o pierde cargas eléctricas. En el laboratorio de la compañía IBM en Zúrich, Suiza, un grupo internacional de científicos, del cual forma parte el físico brasileño Shadi Fatayer, utilizó un microscopio de fuerza atómica (AFM, por sus siglas en inglés) para registrar alteraciones en la geometría, en la distribución de las cargas eléctricas y en las conexiones entre los átomos en las moléculas de cuatro compuestos químicos.
Las moléculas, formadas por conjuntos de dos o más átomos, son las unidades menores en que un compuesto químico –biológico o mineral, natural o sintético– puede dividirse sin perder las propiedades que lo caracterizan. La labor de Fatayer en el grupo comandado por el físico alemán Leo Gross en IBM, consistió en documentar las modificaciones sufridas por las moléculas de azobenceno, pentaceno, tetracianoquinodimetano (TCNQ) y porfirina mientras perdían o ganaban electrones, partículas con carga eléctrica negativa. Al sumar o perder electrones, cada una de esas moléculas presentó alteraciones distintas, relatan los investigadores en un artículo que salió publicado el 12 de julio en la revista Science, en la cual Fatayer, Gross y colaboradores de la empresa ExxonMobil, en Estados Unidos, y de la Universidad de Santiago de Compostela, en España, describen el experimento.
La forma de una molécula define las propiedades químicas, eléctricas y ópticas de un material así como su capacidad para producir reacciones químicas
En el interior de una cámara de ultra alto vacío (UHV, por sus siglas en inglés) mantenida a una temperatura de -268,15 grados Celsius, Fatayer introdujo moléculas aisladas de cada uno de los compuestos orgánicos sobre capas muy puras de cloruro de sodio (NaCl), la sal de cocina, que funciona como aislante eléctrico. A continuación, con la ayuda del microscopio, extrajo o inyectó un electrón por vez en cada molécula. “A partir de ese trabajo, químicos y físicos ahora cuentan con un dispositivo experimental para evaluar las alteraciones en otras moléculas individuales”, dice Fatayer, que es el primer autor del artículo en la Science y actualmente realiza una pasantía de posdoctorado en la filial de IBM en Zúrich.
La primera molécula analizada fue la de azobenceno, un colorante orgánico que, a temperatura ambiente, forma cristales de color anaranjado-rojizo. Cada molécula está conformada por 24 átomos: 12 de carbono (C), 10 de hidrógeno (H) y 2 de nitrógeno (N) y su fórmula química es C12H10N2. Las mismas se organizan en dos anillos de benceno, conjuntos de seis átomos de carbono dispuestos en forma de hexágono, como una celda de un panal de una colmena. Empero, cuando Fatayer inyectó un electrón en la molécula, su geometría cambió. Una de las dos ligaduras que mantenían unidos a los átomos de nitrógeno se rompió y los anillos de benceno se doblaron en sentidos opuestos.
En el caso del pentaceno (C22H14) se registraron transformaciones distintas. Ese semiconductor orgánico presenta sus 22 átomos de carbono y 14 de hidrógeno estructurados en cinco anillos de benceno unidos linealmente. Al extraerles un electrón y, por lo tanto, con una carga positiva sobrante, la molécula se tornó más ancha y menos larga. Cuando Fatayer, en el procedimiento inverso, le agregó un electrón por vez a la molécula hasta llegar a un total de tres, el compuesto se alargó y estrechó.
La fórmula C12H4N4, el TCNQ, es un compuesto que es buen conductor de la electricidad (que se utiliza en la electrónica orgánica) y existe bajo la forma de un polvo verdoso o de cristales amarillos. En su molécula, un anillo de benceno se completa en sus extremidades opuestas con tres átomos de carbono conectados, cada uno de ellos, a uno de nitrógeno, en una estructura que se asemeja a dos brazos abiertos. En la forma neutra, la molécula se adhiere perpendicularmente sobre la base aislante de cloruro de sodio. Sin embargo, al ganar electrones, el anillo de benceno se ubica paralelo al sustrato y las extremidades se curvan, y la curvatura es mayor cuando se agrega un electrón en lugar de dos. “Al añadir o extraer electrones únicos, observamos que eso altera la estructura de la molécula”, dijo Gross en la revista new Scientist. “Sabíamos que ocurría eso, pero no exactamente cómo se modificaba la estructura y eso fue algo muy difícil de observar”.
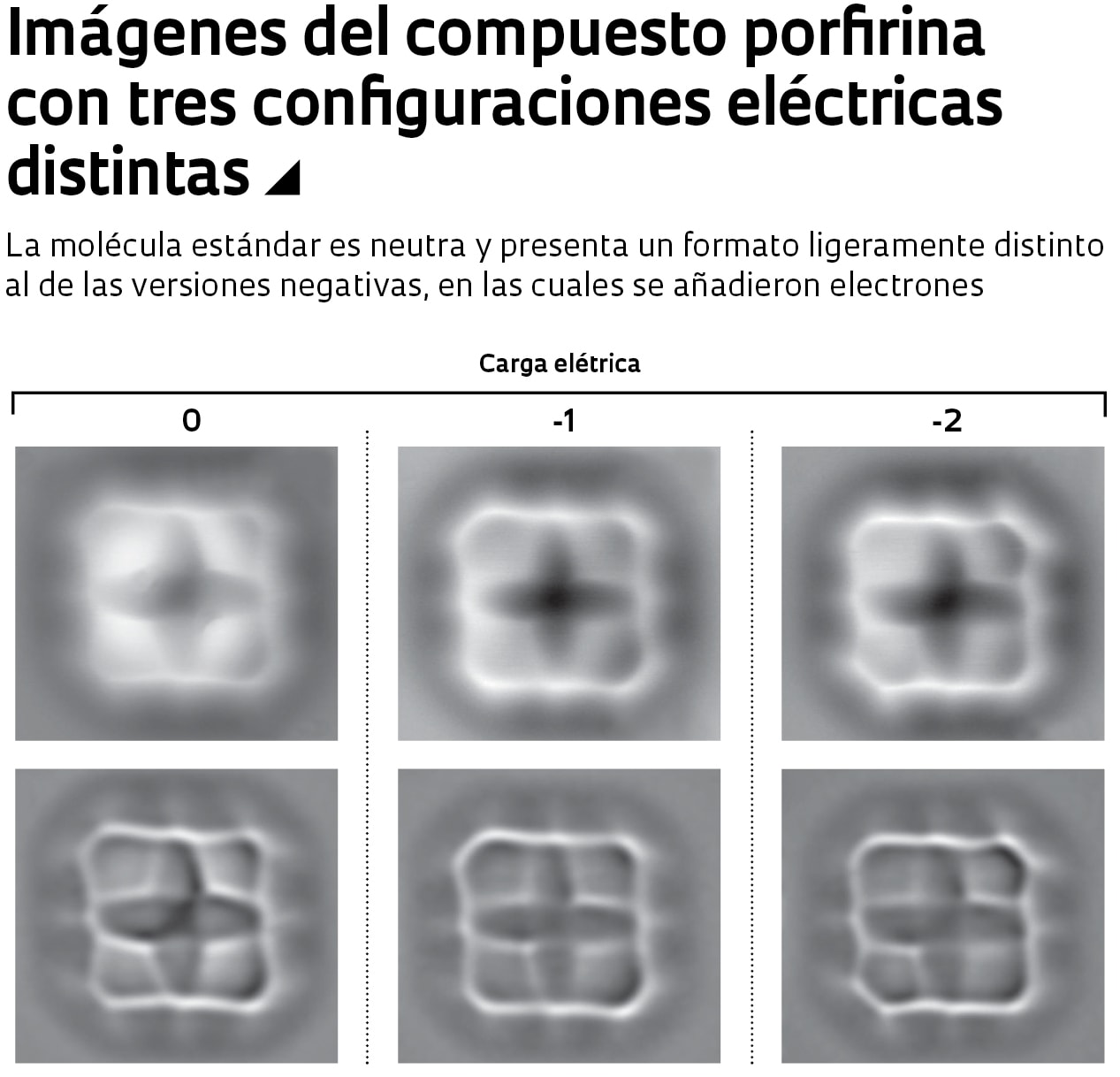
Desde el punto de vista biológico, la molécula más importante que estudiaron Fatayer y sus colegas fue la porfirina (C20H14N4). Ella forma parte del núcleo de dos moléculas esenciales para la vida en la Tierra: la clorofila, que utiliza la luz solar para convertir el dióxido de carbono (CO2) en los azúcares que nutren a las plantas y las hacen crecer; y la hemoglobina, responsable del transporte sanguíneo de las moléculas de oxígeno (O2) utilizado en la producción de energía en los tejidos y para la eliminación de un subproducto de esa reacción química, el CO2. La porfirina presenta una estructura química más compleja que las otras moléculas analizadas y sufrió alteraciones en sus uniones químicas y en la distancia entre sus átomos a medida que se le añadían electrones.
“Los resultados del trabajo del grupo de Zúrich son irrefutables”, comenta el físico Abner de Siervo, de la Universidad de Campinas, quien dirigió a Fatayer en su maestría, que realizó mediante una beca que le concedió la FAPESP. Él explica que la pérdida o la ganancia de electrones puede modificar el formato de una molécula, un parámetro extremadamente importante. “La forma define las propiedades químicas, eléctricas y ópticas de un material”, explica Siervo. “De acuerdo con esas propiedades, pueden producirse determinadas reacciones y otras, no”.

Michael Lowry/ IBM Zúrich
Microscopio de fuerza atómica de la filial de IBM en Zúrich: la empresa ideó ese tipo de dispositivo en la década de 1980Michael Lowry/ IBM ZúrichLa imagen en la punta del átomo
El trabajo que se llevó a cabo con las cuatro moléculas solo fue posible hacerlo gracias a los constantes avances en las técnicas para generar imágenes de moléculas y átomos. Dos físicos de IBM en Zúrich, Heinrich Rohrer (1933-2013) y Gerd Binnig, desarrollaron en 1981 el primer microscopio electrónico de barrido de efecto túnel (STM, en inglés), del cual deriva el microscopio de fuerza atómica (inventado por Binnig y colaboradores cinco años más tarde). Rohrer y Binnig ganaron el Nobel de Física en 1986 por la creación del STM.
El microscopio de fuerza atómica es un dispositivo que puede ocupar casi una habitación completa y alcanza una resolución alrededor de mil veces mayor que la de los microscopios ópticos más potentes. En ellos, la luz reflejada por el objeto observado pasa por un conjunto de lentes y genera una imagen ampliada. En tanto, en los microscopios de fuerza atómica, una punta extremadamente aguda (generalmente metálica o aislante) barre la superficie de la muestra a estudiar sin tocarla. A semejanza del dedo de una persona que lee los relieves de un texto en braille, la punta detecta las fuerzas eléctricas de atracción y repulsión del material y traza un mapa tridimensional, que luego se transforma en imagen. Cuanto menor es el diámetro de la punta, más detalles detecta.
Al final de la década pasada, Leo Gross y quien entonces era el líder del grupo de IBM en Zúrich, el también físico alemán Gerhard Meyer, mejoraron la resolución del microscopio de fuerza atómica añadiéndole a la punta metálica una molécula inerte formada tan solo por dos átomos: el monóxido de carbono (CO), que se adhiere perpendicularmente a la punta metálica. Con el carbono conectado al metal, el oxígeno queda en la extremidad libre y la punta ofrece solamente un átomo de espesor.
Artículo científico
FATAYER, S. et al. Molecular structure elucidation with charge-state control. Science. v. 365, n. 6449, p. 142-5. 12 jul. 2019.


