En el marco de un evento celebrado en septiembre en Estados Unidos, una empresa de ese país que domina el mercado mundial de secuenciadores presentó una nueva máquina. En su versión superior, el dispositivo, que estará disponible para el año que viene a un costo de casi un millón de dólares, promete triplicar la capacidad de lectura de la molécula de ADN, el material genético de las células, que contiene la fórmula de cómo están hechos y funcionan los seres vivos. Si el desempeño fuera el esperado, este secuenciador será capaz de leer el genoma de 20.000 personas por año, a un costo unitario de unos 200 dólares, según consta en un informe publicado en el sitio web de la revista Wired. Es una reducción de costos asombrosa en tan solo dos décadas. El primer borrador del genoma humano, que salió publicado en 2001, requirió el trabajo conjunto de miles de personas y el uso de cientos de máquinas en diversos centros. Llevó años definir el orden de los 3.000 millones de pares de bases nitrogenadas (las unidades químicas que componen el ADN) del genoma: se utilizó el material genético de unos 50 individuos para reunir el equivalente al genoma de una sola persona. Según los cálculos del Instituto Nacional de Investigación del Genoma Humano (NHGRI, por sus siglas en inglés), de Estados Unidos, que coordinó el esfuerzo, solo en la secuenciación se gastaron entre 500 y 1.000 millones de dólares, y el proyecto completo costó 3.000 millones de dólares.
El avance y el abaratamiento de la tecnología de secuenciación, asociados a la evolución de las herramientas bioinformáticas, que permiten analizar grandes volúmenes de datos y comparar las características genéticas de una gran cantidad de personas, están acercando las pruebas genéticas a la práctica clínica, aunque de un modo más lento que lo estimado por los más entusiastas hace dos décadas, cuando se pensaba que la secuenciación del genoma humano aumentaría el poder de los médicos para tratar, prevenir y curar enfermedades. Hoy en día, incluso en Brasil, existen centros especializados donde pueden realizarse toda una gama de test que analizan desde partes de un gen específico a la totalidad del genoma. Debido al alto precio del genoma completo, que aún ronda unos 20.000 reales en los laboratorios privados del país, los médicos solicitan con más frecuencia la secuenciación del exoma para buscar la causa de enfermedades con alta probabilidad de tener un origen genético. Este análisis, que cuesta alrededor de 5.000 reales, permite detectar alteraciones de múltiples genes mediante el análisis de los segmentos codificadores de proteínas de los más de 20.000 genes humanos, que representan menos del 2 % del genoma. En Brasil, los protocolos clínicos y las directrices terapéuticas del Ministerio de Salud prevén su inclusión en el Sistema Único de Salud (SUS), siendo ofrecido para investigar la discapacidad intelectual de naturaleza indeterminada en la infancia. Pero esto todavía no ocurre.

Un investigador introduce una tarjeta con el material genético en el secuenciador…Léo Ramos Chaves / Revista Pesquisa FAPESP
Hasta hace unos años, los estudios de las enfermedades de origen genético buscaban alteraciones en un gen por vez. Se secuenciaba el gen sospechoso de estar asociado a un determinado problema y, cuando no se encontraban mutaciones, se continuaba con el siguiente. “Era un proceso lento, laborioso y caro”, recuerda el médico genetista Roberto Giugliani, de la Universidad Federal de Rio Grande do Sul (UFRGS). “Las tecnologías de secuenciación han progresado exponencialmente a partir del proyecto del genoma humano, ampliando la capacidad de análisis y reduciendo los costos”, dice el investigador, quien también dirige el sector de enfermedades raras de Dasa Genômica, uno de los mayores centros privados de diagnóstico genético de Brasil.
Hoy en día se sigue haciendo el análisis de un solo gen, pero en situaciones específicas, cuando ya se sabe qué alteración genética hay que buscar. Es el caso de algunas enfermedades raras que, individualmente, afectan a un segmento muy pequeño de la población, pero en conjunto aquejan a un 6 % de la población mundial y a unos 13 millones de brasileños. La mayoría de las veces son causadas por defectos en un solo gen (enfermedades monogénicas). Se están adoptando pruebas más abarcadoras, que incluyen el análisis de miles de genes o de millones de puntos del genoma (o incluso su secuenciación completa) y podrían ser de interés para una cantidad mucho mayor de personas en la investigación de diversas enfermedades raras, a la vez que ganan espacio en la cartera de los laboratorios y empresas privadas, que en los últimos años también han pasado a ofrecer los exámenes, por algunos cientos de reales, directamente a los consumidores.
Estas pruebas, apodadas test recreativos, no requieren de una orden médica y suelen comparar tramos del material genético del individuo con información disponible en bases de datos internacionales. Algunas de ellas, las denominadas pruebas de ancestralidad, permiten, por ejemplo, conocer la probable región geográfica de origen de los antepasados. Otras pretenden identificar, a partir de la información de los genes, la dieta o el tipo de actividad física más adecuada o incluso comprobar la presencia de variantes genéticas que podrían predisponer a una serie de enfermedades que afectan a un alto porcentaje de la población, tales como la diabetes tipo 2, los problemas cardiovasculares o el cáncer. “Estos exámenes genéticos destinados directamente al consumidor se han convertido en el mayor producto genético para la población en general”, informa el genetista Michel Naslavsky, docente en la Universidad de São Paulo (USP) e investigador del Instituto Israelita de Ensino e Pesquisa Albert Einstein, que investiga las alteraciones genéticas que entrañan riesgo de desarrollo de enfermedades.
Sin embargo, la cantidad y el tipo de información genética que analizan las pruebas directas para el consumidor no ofrecen un diagnóstico ni una estimación precisa del riesgo para esas enfermedades, ni proporcionan orientación específica sobre cómo prevenirlas. Al igual que las enfermedades monogénicas, las enfermedades más comunes también tienen un componente genético de peso. Pero existe una diferencia fundamental. En las enfermedades comunes este componente depende de la interacción entre cientos o miles de genes (son poligénicas), y cada uno de ellos contribuye muy poco al efecto final. Por este motivo, es menester que ocurran alteraciones en un gran número de esos genes para que la enfermedad se manifieste. El hallazgo de defectos en uno o en un puñado de ellos suele no significar nada –esto mismo vale para los rasgos complejos, tales como el desarrollo de la fuerza muscular, la acumulación de grasa corporal o la estatura–, toda vez que siempre está presente la influencia de los factores ambientales.
“Los test vendidos directamente al consumidor utilizan datos genéticos que permiten develar aspectos peculiares del individuo, como su ascendencia, pero no son capaces de aportar evidencias que permitan orientar la práctica médica”, señala la médica genetista Rayana Maia, docente en la Universidad Federal de Paraíba (UFPB) y directora del Departamento de Ética de la Sociedad Brasileña de Genética Médica y Genómica (SBGM). “Muchas de las variantes genéticas [versiones alteradas de los genes] identificadas con estas pruebas no están asociadas a un riesgo importante de enfermedad. El resultado puede acarrear más angustia que beneficio”, concluye.
… y luego analiza el resultadoLéo Ramos Chaves / Revista Pesquisa FAPESP
Con potencial de uso clínico o tan solo recreativo, el hecho es que los test genéticos representan un negocio multimillonario, que según algunos análisis, crece a una tasa de casi un 10 % anual. En un informe divulgado hace unos meses, la empresa estadounidense Straits Research, que realiza análisis de mercado, estimó que, en 2021, estas pruebas movieron 14.800 millones de dólares a nivel mundial, cifra que llegaría a 36.000 millones de dólares en 2030.
Ante tanta oferta, surgen preguntas: ¿quiénes deben realizarse un test genético? ¿Cuándo?
La respuesta es…depende. Si fuera para conocer con algo más de detalle de dónde proceden sus antepasados, no hay problema. Pueden hacerlo cuando lo deseen. Pero es bueno tener en cuenta que el resultado puede variar según la empresa que provee el test. Los datos genéticos de la persona se cotejan con la información de decenas de miles de individuos almacenadas en la base de datos del proveedor de la prueba. Por lo general, estas bases de datos están compuestas por información de personas que viven en Europa y Estados Unidos, cuya ascendencia es mayoritariamente caucásica. “Uno de estos exámenes realizado con el material genético de un brasileño, por ejemplo, es posible que no identifique la existencia de antepasados nativos de América del Sur o de alguna región de África”, dice Maia.
Ahora bien, si el propósito fuera descubrir si hay alto riesgo de desarrollar alguna enfermedad en el futuro o transmitir a un hijo una alteración genética asociada a una enfermedad grave, la respuesta cambia. “La prueba genética de diagnóstico solo debe realizarse con orientación médica y en una situación que requiera de una comprobación genética, porque si no hubiera una indicación específica, el resultado podría traer más daños que beneficios al individuo”, dice el médico genetista José Cláudio Casali da Rocha, creador y coordinador del centro de Oncogenética del A.C.Camargo Cancer Center de São Paulo. “Podría generarse en la persona un padecimiento permanente por temor a desarrollar una enfermedad que posiblemente nunca se manifieste”, explica.
El problema es hacer un test, incluso si es recreativo, con la finalidad de conocer el propio perfil genético y saber si las células contienen versiones (variantes) de genes que de alguna forma pueden estar asociadas a enfermedades. “Los exámenes genéticos, en sus diferentes tipos, son herramientas de diagnóstico poderosas que, en general, permiten poner fin a una larga búsqueda del origen de una enfermedad de causa desconocida”, dice el endocrinólogo Alexander Jorge, de la USP, experto en enfermedades genéticas. “Cuando se realizan sin una indicación precisa, sin una pregunta a la que responder, pueden revelar alteraciones que no tienen ningún significado clínico y conducir a interpretaciones erróneas”.
En la especie humana, el genoma de un individuo es un 99,9 % idéntico al de otro. Esto significa que, casi en su totalidad, la secuencia de las cuatro bases nitrogenadas –adenina (A), timina (T), citosina (C) y guanina (G)– en el material genético de dos individuos, ya sean gemelos idénticos o hayan nacido en las antípodas del planeta, es la misma. Lo que hace a un ser humano diferente de otro es ese 0,1 %, que representa 3 millones de pares de estas bases. “El número de variaciones en el genoma de dos seres humanos sanos es enorme, pero son muy pocas las que tienen una influencia conocida sobre la salud y, a menudo, resulta difícil identificar cuál o cuáles de ellas están asociadas a un problema”, explica Giugliani, de la UFRGS.
El progreso de las técnicas de secuenciación y análisis genético en las últimas décadas ha aumentado drásticamente la cantidad de genes y variantes conocidas que desempeñan algún papel en las enfermedades. El avance más claro y significativo se produjo en el campo de las monogénicas. En ellas, la alteración de un único gen tiene un impacto devastador, suficiente para generar un menoscabo importante de alguna función del organismo. Estas enfermedades suelen ser graves –algunas fatales, como la atrofia muscular espinal– y ya se manifiestan en la infancia.
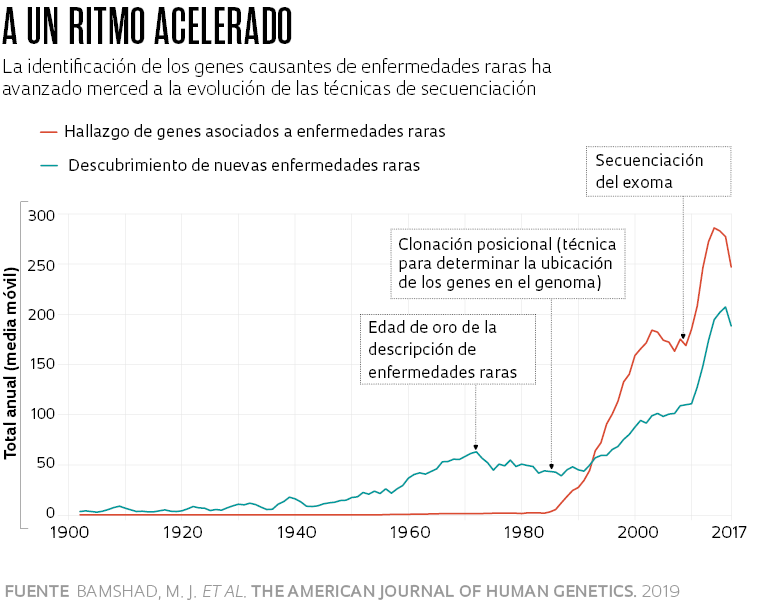
En un comentario publicado en 2019 en la revista The American Journal of Human Genetics, el pediatra Michael Bamshad y colaboradores, de la Universidad de Washington, en Estados Unidos, señalaban que la descripción de estas enfermedades y la identificación de los genes que las causaban solo avanzaron velozmente a partir de mediados de la década de 1980, con la evolución de las técnicas de secuenciación y el Proyecto Genoma Humano (véase el gráfico). Hasta entonces, solamente se habían caracterizado unos 40 genes causantes de algunas de ellas. Hasta el 21 de noviembre, se habían identificado alteraciones en 4.721 genes asociados a 7.286 enfermedades raras, según la base Online Mendelian Inheritance in Man (Omim).
En estos casos, las pruebas genéticas desempeñan un papel importante para mejorar la identificación y, cuando estuviera disponible, el tratamiento precoz, además de la prevención, que se realiza mediante el asesoramiento genético de las familias que poseen la versión alterada del gen y planean tener hijos. “Algunas enfermedades raras son muy difíciles de reconocer basándose solamente en el cuadro clínico”, dice Alexander Jorge, de la USP. “En estos casos, la secuenciación del exoma acorta el tiempo de diagnóstico, reduce costos y permite orientar a la familia”.
La identificación de la causa de las enfermedades genéticas mejora la calidad de vida al permitirle al médico seleccionar la medicación más eficaz para mitigar los síntomas y evitar aquellos fármacos que los acentúan. También ayuda a preparar a los padres y cuidadores para la evolución de la enfermedad. “Todavía no se dispone de terapias que permitan modificar los genes y curar estas dolencias, pero en muchas de ellas pueden tratarse los síntomas y ofrecerle una calidad de vida mejor al niño”, dice la genetista Maria Rita Passos-Bueno, quien en colaboración con la genetista Mayana Zatz, coordina el Laboratorio de Test Genéticos (LabTEG) del Centro de Estudios del Genoma Humano y Células Madre (CEGH-CEL) de la USP.
Una de las áreas que más se han beneficiado de las pruebas genéticas es la oncología. Si bien pueden manifestarse con características diversas (evolución rápida o lenta; alto o casi nulo potencial de cura), los distintos tipos de cáncer conocidos son enfermedades esencialmente genéticas. Las alteraciones en uno o más genes modifican la programación de las células y las inducen a multiplicarse en forma descontrolada, dañando los órganos.
En los últimos años, los oncólogos han empezado a utilizar diversos tipos de pruebas para rastrear alteraciones en el genoma que es sabido que aumentan la probabilidad de padecer cáncer y tratar de reducir el riesgo de desarrollo de la enfermedad. También han comenzado a valerse de la información genética que proporcionan los tumores para seleccionar la medicación y la dosis más adecuadas para cada individuo, o incluso los tratamientos que deben evitarse. Consorcios internacionales y agencias reguladoras de medicamentos como la FDA, de Estados Unidos, ya enumeran más de 250 fármacos (varios de uso oncológico) etiquetados para ser prescritos en función del perfil genético de los pacientes. “Los exámenes genéticos ayudan a identificar las vías bioquímicas que el tumor está utilizando para crecer y a determinar qué fármacos pueden inhibir o bloquear su funcionamiento”, comenta Casali, del A.C.Camargo.
Uno de los retos pendientes reside en hallar la forma de extraer del perfil genético información que permita estimar el riesgo de desarrollar enfermedades comunes
Años atrás, estudiando el perfil genético de 192 brasileñas que padecían un tipo de cáncer de mama que crece por acción de la hormona femenina estrógeno, Casali y sus colaboradores descubrieron que no todas respondían como se esperaba al tratamiento con el fármaco tamoxifeno. Este compuesto inhibe la producción de las moléculas a las cuales se une la hormona en la superficie de las células tumorales, reduciendo la acción de los estrógenos. Se administra en una versión inerte, que se activa en el hígado por intermedio de la enzima CYP2D6. Las mujeres que presentan una alteración en este gen producen una versión de la enzima menos funcional. Según indica el trabajo, publicado en 2020 en la revista Clinical and Translational Science, esta característica explicaba en parte por qué en estas personas el nivel del medicamento activo en sangre era inferior al necesario para evitar la reaparición del cáncer.
En un ensayo clínico de fase II, el equipo del oncólogo Fabrice André, del centro especializado en cáncer Gustave Roussy, de París, sometió a 238 mujeres con cáncer de mama con metástasis a dos tratamientos: 157 recibieron fármacos específicos para contrarrestar los efectos de las alteraciones genéticas características de sus tumores y 81 fueron tratadas con la quimioterapia tradicional. Tras efectuar un seguimiento de las pacientes por casi dos años, el primer grupo había logrado frenar la progresión de la enfermedad, en promedio, durante nueve meses, y el segundo, por menos de tres meses, según consta en un artículo publicado en el mes de julio en la revista Nature.
Uno de los retos pendientes reside en hallar la forma de extraer del perfil genético información confiable para estimar el riesgo de desarrollar enfermedades comunes, que afectan a una porción importante de la población, como las cardiovasculares o la diabetes. Según los estudios genéticos, en la mayoría de los casos, estas enfermedades son causadas por alteraciones en una gran cantidad de genes. Cada alteración tiene una contribución menor en la enfermedad –en los casos más significativos, una variante puede explicar el 0,2 % del riesgo de padecer la enfermedad–, pero sus efectos son acumulativos.
En los últimos años, el área de la genética ha empezado a probar la idea de utilizar una fórmula matemática –la puntuación de riesgo poligénico– para estimar la probabilidad de desarrollar estas enfermedades. En síntesis, esa puntuación, o perfil de riesgo, consiste en la suma del efecto de todas las variantes de riesgo del individuo, teniendo en cuenta la contribución de cada una de ellas. Según un artículo de revisión publicado en 2018 en la revista Nature Reviews Genetics por el químico especializado en informática y genómica Ali Torkamani, del Instituto de Investigación Scripps, de Estados Unidos, estudios recientes comienzan a demostrar la utilidad de esas puntuaciones para identificar a los grupos de individuos más susceptibles de desarrollar algunas de esas enfermedades, quienes podrían beneficiarse de un seguimiento específico o de intervenciones médicas.

Algunos test genéticos pierden poder predictivo en poblaciones mestizadas, como la brasileñaLéo Ramos Chaves / Revista Pesquisa FAPESP
En el Centro de Medicina Genómica del Hospital General de Massachusetts (EE. UU.), el grupo del cardiólogo y genetista Sekar Kathiresan desarrolló hace unos años una puntuación de riesgo poligénico para la obesidad, con base en la información de 2,1 millones de variantes genéticas de reconocida influencia sobre el índice de masa corporal (IMC). La herramienta fue puesta a prueba utilizando la información genética y los parámetros de salud de 300.000 personas. La puntuación permitió ponderar el riesgo de llegar a tener obesidad mórbida –tener un IMC superior a 40 kg/m2; la condición saludable es entre 18 y 25 kg/m2– y el aumento de la probabilidad de desarrollar ciertas enfermedades. El 10 % de los individuos con el mayor número de variantes de riesgo eran 25 veces más propensos a volverse hiperobesos que el 10 % con menor cantidad de alteraciones. En el primer grupo, el riesgo de padecer diabetes, trombosis y desarrollar hipertensión fue, respectivamente, un 70 %, un 40 % y un 35 % más elevado, según los resultados publicados en 2019 en la revista Cell.
Pese a ser prometedores, los puntajes de riesgo poligénico aún están lejos de ser una realidad en los consultorios médicos. Previamente, deberán validarse en muestras amplias de poblaciones de diferentes regiones del planeta. Se sabe, por ejemplo, que estas herramientas creadas a partir de los datos genéticos de grupos cuya ascendencia es mayoritariamente europea, pierden poder predictivo para poblaciones mestizadas. Al investigar el desempeño de un puntaje para predecir la estatura de las personas, una característica que puede medirse fácilmente, la genetista brasileña Bárbara Bitarello, quien realiza una pasantía posdoctoral en la Universidad de Pensilvania (EE. UU.), comprobó que el poder predictivo de la herramienta disminuía entre cuatro y cinco veces en grupos de ascendencia africana, según consta en un estudio publicado en 2020 en la revista Genes, Genomics, Genetics.
En estas circunstancias, la ascendencia deja de ser solamente una curiosidad y pasa a revestir importancia médica. “Los estudios han empezado a demostrar que, para calcular el riesgo genético de desarrollar un problema de salud, será importante tener en cuenta la ancestralidad”, dice el genetista Eduardo Tarazona Santos, de la Universidad Federal de Minas Gerais (UFMG), quien estudia la ascendencia de la población brasileña. Él explica que el efecto de algunas variantes genéticas puede diferir en función de haber sido heredadas de poblaciones africanas, europeas o amerindias.
Un estudio dirigido por Michel Naslavsky y Claudia Suemoto, de la USP, que salió publicado en septiembre en la revista Molecular Psychiatry, en el cual participó Tarazona, reveló que tanto la versión de un gen que eleva el riesgo de padecer alzhéimer como la que protege contra esta enfermedad presentan en las poblaciones de origen africano un efecto atenuado en comparación con la de origen europeo. “Por ahora, los resultados de la puntuación de riesgo poligénico deben evaluarse con cautela. Ya se han propuesto más de 2.000 puntajes, pero pocas decenas han sido validadas en poblaciones latinoamericanas”, dice Tarazona.
Proyectos
1. CEGH-CEL – Centro de Estudios del Genoma Humano y Células madre (nº 13/08028-1); Modalidad Centros de Investigación, Innovación y Difusión (Cepid); Investigadora responsable Mayana Zatz (USP); Inversión R$ 54.769.696,92.
2. INCT 2014 – Envejecimiento y enfermedades genéticas. Genómica y metagenómica (nº 14/50931-3); Modalidad Proyecto Temático; Investigadora responsable Mayana Zatz (USP); InversiónR$ 2.913.294,82.
Artículos científicos
BAMSHAD, M. J. et al. Mendelian gene discovery: Fast and furious with no end in sight. The American Journal of Human Genetics. v. 105, p. 448-55. 5 sept. 2019.
NARDIN, J. M. et al. The influences of adherence to tamoxifen and CYP2D6 pharmacogenetics on plasma concentrations of the active metabolite (z)-endoxifen in breast cancer. Clinical and Translational Science. v. 13, p. 284-92. 2020.
ANDRÉ, F. et al. Genomics to select treatment for patients with metastatic breast cancer. Nature. 3 jul. 2022.
TORKAMANI, A. et al. The personal and clinical utility of polygenic risk scores. Nature Reviews Genetics. v. 19, p. 581-90. sept. 2018.
KHERA, A. V. et al. Polygenic prediction of weight and obesity trajectories from birth to adulthood. Cell. v. 177, p. 587-96. 18 abr. 2019.
BITARELLO, B. D. y MATHIESON, I. Polygenic scores for height in admixed populations. Genes, Genomes, Genetics. nov. 2020.
NASLAVSKY, M. S. et al. Global and local ancestry modulate APOE association with Alzheimer’s neuropathology and cognitive outcomes in an admixed sample. Molecular Psychiatry. 7 sept. 2022.