
Isadora Clivatti Furigo/ USP
Sometido a la privación de alimento, la hormona del crecimiento activa las neuronas del hambre (los círculos rojos en la imagen de arriba)Isadora Clivatti Furigo/ USPTodos aquellos que han hecho una dieta para adelgazar conocen el proceso. Una vez vencida la abulia y comenzado el régimen, los dígitos de la balanza al principio suelen ceder, sea cual sea la estrategia adoptada. Lo difícil es mantener el ritmo de adelgazamiento. Incluso con la ayuda de medicamentos, en pocas semanas el peso se estanca o peor, vuelve a subir. La forma en que el organismo de los seres humanos y de otros animales se adaptó en el curso de la evolución explica, en parte, la dificultad para adelgazar. Miles de años de escasa disponibilidad de alimentos (cuya obtención exigía un esfuerzo físico) dotaron al cuerpo de potentes y complejas estrategias para economizar energía. En experimentos con ratones, el grupo coordinado por el fisiólogo José Donato Junior, del Instituto de Ciencias Biomédicas de la Universidad de São Paulo (ICB-USP), describió otro mecanismo que interviene contra la pérdida de peso.
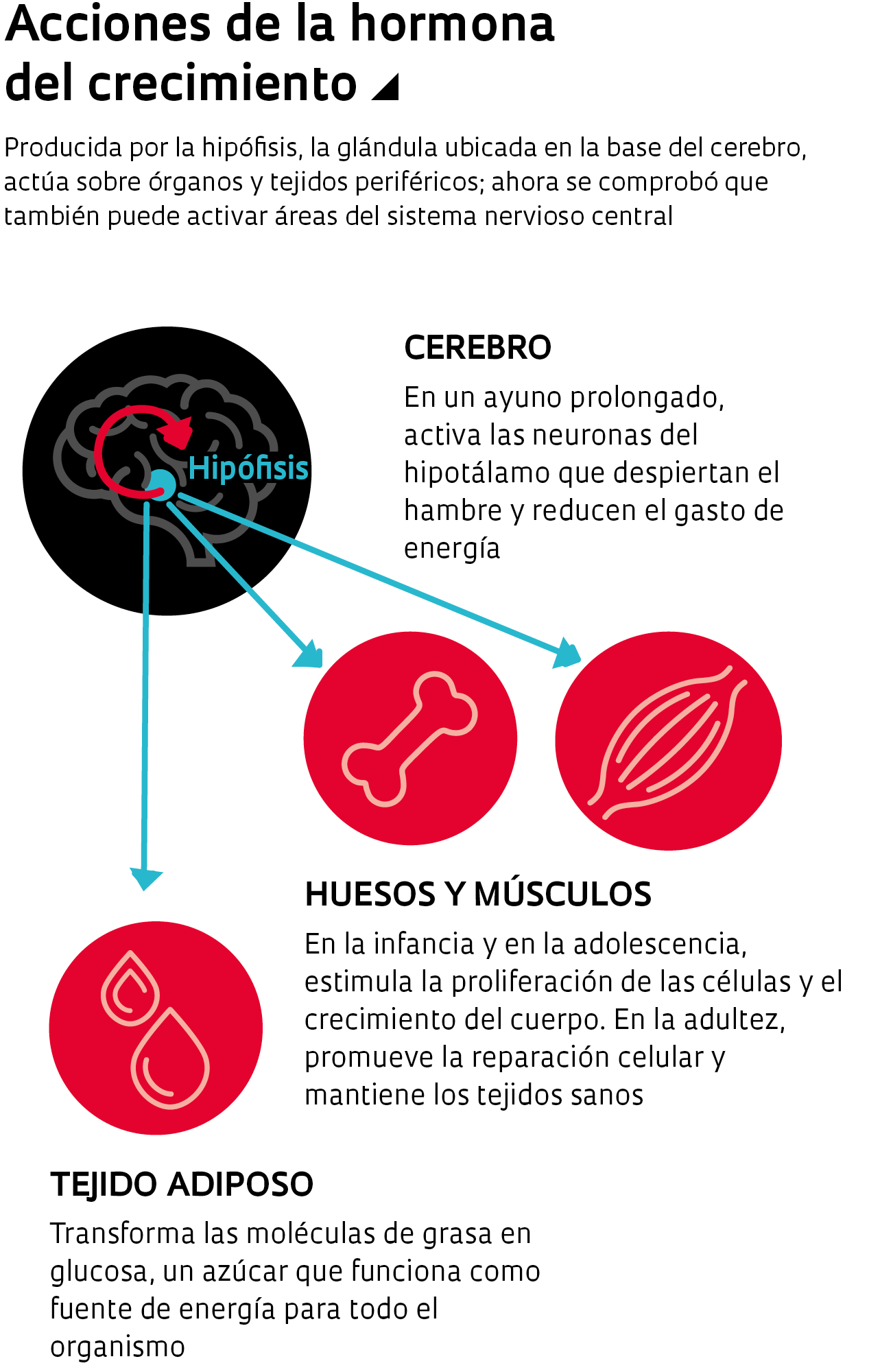
Su artífice es un compuesto hasta ese momento insospechado: la hormona del crecimiento. Esa hormona, conocida desde hace casi un siglo y producida por la hipófisis, una glándula alojada en la base del cerebro, actúa sobre los tejidos periféricos. Secretada en mayor cantidad durante el sueño, eleva el gasto de calorías, liberando la energía almacenada en el tejido adiposo e induciendo la multiplicación y reparación de las células en huesos, músculos y vísceras. Ahora, el equipo de la USP verificó que cuando se come menos que lo habitual, esa hormona funciona de manera diferente. Ella activa una región del cerebro que aumenta el hambre y reduce el gasto de energía. Como consecuencia, resulta más difícil adelgazar.
Donato y sus colaboradores presentaron evidencias de ese efecto, nunca antes advertido, en experimentos con ratones descriptos en un artículo que salió publicado en la edición del 8 de febrero de la revista Nature Communications. “Al restringir la ingesta de calorías el nivel de esa hormona aumenta e induce al cuerpo a entrar en modo de supervivencia: ella deja de influir sobre el crecimiento y le indica al cuerpo que necesita comer y guardar energía”, explica el fisiólogo.
Este hallazgo, en cierto modo, sorprende a los especialistas del área. “En general, suelen identificarse funciones nuevas para hormonas ya conocidas, pero ninguna tan importante como esta”, dice el endocrinólogo Lício Velloso, de la Universidad de Campinas (Unicamp) y estudioso de los mecanismos bioquímicos asociados a la obesidad y a la diabetes. “Nunca había sido tan evidente que esa hormona pudiera regular en el cerebro el hambre y el consumo energético”.
Desde los años 1960 se sabe que el ayuno incrementa la liberación de la hormona del crecimiento. En pruebas con voluntarios sanos realizadas en un hospital de Nueva York, el médico Solomon Berson (1918-1972) y la física-médica Rosalyn Yalow (1921-2011) notaron que la privación prolongada de nutrientes (dos días y medio sin comer) aumentaba la liberación de hormona del crecimiento. Sin embargo, no se sabía cuáles eran las consecuencias de eso ni por qué ocurría. “Parecía ser un efecto contradictorio”, relata Donato. “¿Por qué ante la ausencia de nutrientes el organismo redoblaría sus esfuerzos en crecer, algo que insume más energía?”
La respuesta vino con los resultados que se publicaron en febrero. Como estaba interesado en conocer cómo actúan las hormonas sobre el sistema nervioso central, Donato y su equipo se enfocaron en el cerebro, en lugar de estudiar los tejidos periféricos, como hacen otros grupos. “La acción de la hormona del crecimiento sobre los centros reguladores del hambre no se estaba teniendo en cuenta”, comenta el bioquímico brasileño Marcelo Dietrich, de la Escuela de Medicina de la Universidad Yale, en Estados Unidos, que estudia los mecanismos bioquímicos que controlan el hambre y la saciedad.
El primer paso consistió en determinar dónde actuaba en el cerebro la hormona del crecimiento y su efecto sobre el hambre y el consumo de energía. En un test inicial, la fisióloga Isadora Clivatti Furigo, en su posdoctorado bajo la supervisión de Donato, suministró a roedores sanos hormona del crecimiento marcada con un material que permite su rastreo. A continuación, examinó el hipotálamo, una pequeña región del cerebro asociada al control de la temperatura corporal, de la sed, del cansancio, del sueño y, por supuesto, del hambre. Ella notó que la hormona se unía a las células de al menos diez áreas. Una en particular le llamó la atención: el núcleo arqueado. Esa área diminuta contiene un grupo pequeño de células (algunos miles en los ratones) a las que se sabe asociadas a la regulación de la ingesta de alimentos y del gasto energético. Estas células, a las cuales se las denomina con el mote de neuronas del hambre, producen dos compuestos –el neuropéptido al cual se lo conoce por la sigla AgRP y el neuropéptido Y (NPY), razón por la cual se las denomina neuronas AgRP/ NPY– que actúan en otras regiones cerebrales e impulsan al cuerpo a buscar comida.
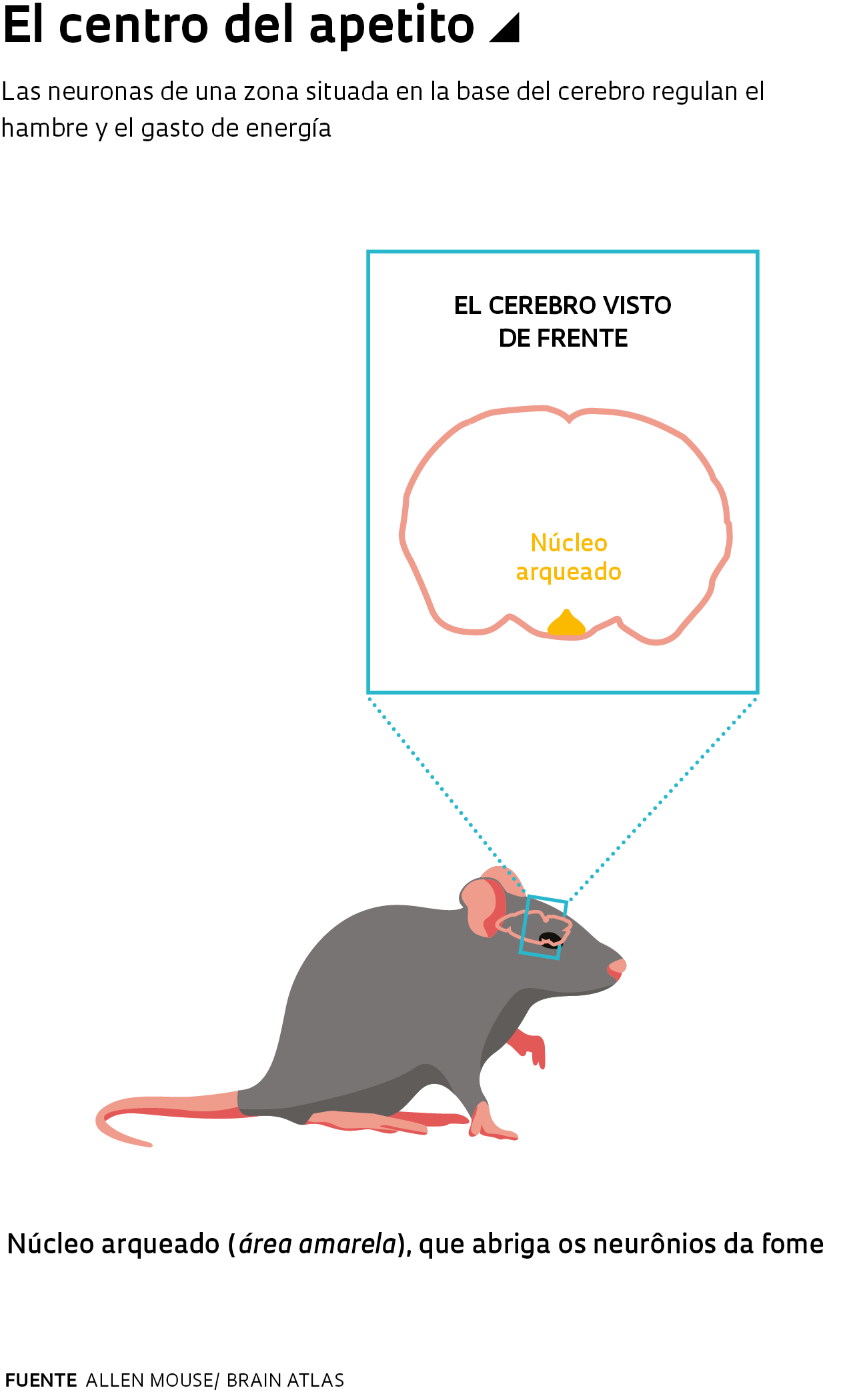
Un disparador del hambre
El aumento en la concentración de hormona del crecimiento en el hipotálamo, de hecho, despertó a las neuronas del hambre. Un día después de recibir una dosis de la hormona, los roedores empezaron a comer más que los ratones tratados con una solución inocua (placebo). Los animales del primer grupo también gastaban menos energía que los del segundo, sugiriendo que los niveles elevados de hormona del crecimiento en el cerebro funcionaban como un disparador del hambre y de la economía de energía. “El trabajo actual inaugura un nuevo campo de investigación”, dice el endocrinólogo Cesar Boguszewski, coordinador de la Unidad de Neuroendocrinología del Hospital De Clínicas de la Universidad Federal de Paraná (UFPR). “En el caso de que este efecto también sea detectado en los seres humanos, eso podría ayudar a entender por qué las dietas para adelgazar muchas veces fallan”.
Para confirmar que el aumento del hambre era una consecuencia de la acción de esa hormona sobre las neuronas AgRP/ NPY, los investigadores resolvieron insensibilizarlos a la hormona del crecimiento. Donato y Furigo recibieron ratones alterados genéticamente que no presentaban al receptor de la hormona en todo el cerebro. Esos roedores fueron preparados por el biólogo molecular estadounidense John Kopchick, de la Universidad de Ohio, Estados Unidos, quien desarrolló un medicamento que impide la acción de la hormona del crecimiento. En el Laboratorio de Neuroanatomía Funcional de la USP, el dúo brasileño restringió la ausencia del receptor solo a las neuronas del hambre valiéndose de una estrategia de manipulación genética denominada recombinación Cre-Lox, que es anterior a la Crispr, que hoy en día está en boga.
Los ratones privados del receptor de la hormona en las neuronas AgRP/ NPY, tratados con la dieta estándar de los laboratorios, comían lo mismo que los animales sin esa alteración genética. También presentaban un nivel de actividad, peso y composición corporal (porcentaje de masa grasa) similar. Cuando se los sometía durante cinco días a una dieta en la cual ingerían un 40% de la cantidad normal de ración, los animales sin la alteración genética pasaron a moverse menos y a economizar energía. En tanto, los ratones con las neuronas del hambre sin receptor de la hormona del crecimiento casi no registraron alteraciones en su nivel de actividad. En esa coyuntura, este grupo adelgazó más: perdió un 20% más de peso, principalmente masa grasa, que los animales del primer grupo. “Sin el receptor para la hormona del crecimiento, las neuronas AgRP/ NPY parecen no percibir adecuadamente la privación de alimentos”, relata Furigo.
En la fase siguiente, los científicos testearon algo más similar a un posible tratamiento de pérdida de peso para seres humanos. Ellos restringieron la cantidad de alimento y proporcionaron a los roedores dos dosis diarias de pegvisomant, un fármaco que se utiliza en el tratamiento de individuos con acromegalia, en la cual se registra un crecimiento exagerado de las extremidades del cuerpo debido a una producción excesiva de hormona del crecimiento en la adultez. Con ello, intentaban maximizar la pérdida de peso sin alterar los genes. Con los roedores eso funcionó. Los ratones tratados con pegvisomant adelgazaron más que los del grupo tratado con placebo porque mantuvieron un gasto energético elevado incluso pasando hambre. “Ese resultado constituye una prueba de concepto de que acaso sea posible utilizar ese tipo de medicamento para ayudarles a las personas a perder más peso”, sugiere Donato. “En una dieta, un tratamiento con ese compuesto tal vez logre que los niveles de hormona del crecimiento retornen a valores normales y, así, se reduzca el hambre manteniendo el gasto de energía”.
Una alternativa deseable
Los científicos sospechan que el efecto observado en ratones también ocurriría en otros animales y en los seres humanos. “Los mecanismos fundamentales para la supervivencia suelen preservarse a lo largo de la evolución”, recuerda Dietrich, de Yale. Con todo, la confirmación de ese efecto benéfico y la verificación de eventuales efectos colaterales requerirán muchos experimentos. Si eso funcionara tal como está previsto sería una alternativa bienvenida para ayudar en el tratamiento de la obesidad. Es urgente hallar formas efectivas de controlar el exceso de peso, un problema que afecta a 1.900 millones de personas en el mundo y, en el caso humano, las causas son múltiples (genéticas, ambientales y comportamentales).
Aunque el bloqueo de la hormona propicie la pérdida de peso en humanos, Boguszewski, de la UFPR, anticipa cierta dificultad para la adopción de esa estrategia en la práctica clínica. “En primer lugar debería limitarse su efecto a un área determinada del cerebro”, dice el investigador, que estudia la acción periférica de la hormona del crecimiento. Casi todos los tejidos del cuerpo poseen receptores para ella e impedir su actividad normal puede acarrear consecuencias graves. “Aún nos encontramos en la etapa de intentar comprender mejor el funcionamiento del hipotálamo, antes de pensar en estrategias terapéuticas más eficientes”, advierte Velloso. “Desde el punto de vista biológico, estamos protegidos para no morir de inanición”.

Léo Ramos Chaves
Hermanos y diferentes: el ratón obeso (a la izq.) no produce el receptor de la leptinaLéo Ramos ChavesInmediatamente después de su descubrimiento en 1994, la leptina, producida por el tejido adiposo, se tornó conocida como la hormona de la saciedad. Ella le indica al cerebro si la reserva de energía almacenada en forma de grasas es adecuada o bien, si es necesario comer. Sin embargo, esa no es su única función. En el comienzo de la vida ella es importante para el desarrollo del cerebro y de los sistemas inmunológico y reproductivo. Faltaba saber si los efectos de su carencia podrían ser revertidos.
“Algunos sí; otros tan solo en forma parcial”, sostiene el fisiólogo José Donato Junior, de la USP. La fisióloga Angela Ramos Lobo y Donato, su supervisor en el doctorado, idearon una estrategia sofisticada para verificar esa posibilidad. Ellos desactivaron en roedores el gen que codifica el receptor de la leptina. Los ratones producían la leptina, pero el cuerpo no percibía su efecto.
Los investigadores reactivaron ese gen en la cuarta semana de vida de un grupo de animales y en la décima de otro –edades que corresponden al final de la infancia y a la adolescencia en los seres humanos– y los monitorearon durante más de seis meses.
Al igual que los roedores que no producen leptina, aquellos animales privados de su acción al comienzo de su vida comían de más, gastaban poca energía y eran obesos e infértiles. También presentaban un cerebro de un tamaño un 10% menor que los del grupo de control.
Una vez restablecida la actividad de la leptina, los animales empezaron a comer menos, adelgazaron y, en parte, recuperaron el desarrollo cerebral. De cualquier modo, siguieron siendo obesos, infértiles y con mayor propensión a padecer diabetes, según el artículo que salió publicado el 29 de enero en la revista eLife. “La señalización de la leptina durante el inicio del desarrollo define el modelo de gasto energético”, explica Donato.
Se sospecha que estos hallazgos podrían aplicarse a los seres humanos. Si bien la deficiencia de leptina es rara (se conocen unos 30 casos en todo el mundo), la señalización disfuncional es algo común, emergente de una carencia nutricional o del exceso de peso en la infancia, siendo que en estos casos el cuerpo produce la hormona pero no la reconoce. “Ante esta situación, lo importante es intervenir pronto mediante una reposición o alteración de los hábitos alimentarios para garantizar el mejor desarrollo posible”, dice Lício Velloso, de la Unicamp.
Proyectos
1. Acción de la hormona del crecimiento sobre el sistema nervioso: su importancia para las funciones neuronales y en enfermedades (nº 17/02983-2); Modalidad Proyecto Temático; Investigador responsable José Donato Junior (ICB-USP); Inversión R$ 1.238.502,38
2. Estudio de los efectos centrales de la hormona del crecimiento sobre el metabolismo energético y control glucémico (nº 16/09679-4); Modalidad Beca en el País – Posdoctorado; Investigador responsable José Donato Junior (ICB-USP); Becaria Isadora Clivatti Furigo; Inversión R$ 296.549,92
Artículo científico
FURIGO, I. C. et al. Growth hormone regulates neuroendocrine responses to weight loss via AgRP neurons. Nature Communications. 8 feb. 2019.

