La pasión de Glaucius Oliva por domar proteínas para el desarrollo de fármacos nació mientras cursaba la carrera de grado, de un desafío de ingeniería: descubrir cómo unir decenas de pequeñas piezas de plástico bajo la forma de una molécula de mioglobina. Fueron meses de trabajo para calcular la posición y la orientación exactas de cada átomo y posicionarlos todos, agujereando las partes y encajándolas en alambres cortados con la longitud precisa. A partir de entonces, aquel estudiante de ingeniería eléctrica ya sabía qué era lo que quería hacer.
Pero no sabía que ese interés científico le exigiría además que se dedicara, desde el inicio de su vida como graduado, a congregar a expertos de diferentes áreas para trabajar en conjunto y a convencer a agencias de fomento a financiarlos. Glaucius Oliva se convirtió entonces un destacado gestor, tanto de grandes proyectos interdisciplinarios como al frente del Consejo Nacional de Desarrollo Científico y Tecnológico (CNPq), que presidió entre 2011 y 2015. Profesor del Instituto de Física en el campus de São Carlos de la Universidad de São Paulo (USP), actualmente dirige el Centro de Investigación e Innovación en Biodiversidad y Fármacos (CIBFar), uno de los Centros de Investigación, Innovación y Difusión (Cepid) financiados por la FAPESP.
Oliva concedió esta entrevista en su despacho decorado con el modelo molecular montado hace alrededor de 40 años (con él en la foto de al lado), en un instituto prácticamente vacío en vísperas de Navidad. Su laboratorio estaba activo.
Especialidad
Cristalografía, estructura de proteínas
Institución
Instituto de Física de São Carlos de la Universidad de São Paulo (USP)
Estudios
Carrera de grado en ingeniería eléctrica (1981) y maestría en física por la USP (1983), doctorado en cristalografía de proteínas por la Universidad de Londres (1988)
Producción científica
163 artículos científicos
Su trabajo lo ha hecho destacarse tanto en gestión como en investigación. ¿Cuál es su principal faceta?
Esas dos cosas están enmarañadas en mi historia. Nunca he dejado de hacer investigación. Incluso durante el ejercicio de cargos de gestión administrativa estuve en el laboratorio. Es más, me parece pésimo cuando el investigador se vuelve gestor y se olvida de su vida. En general la desconexión con su actividad fin lo hace distanciarse de las dificultades, de los problemas, de los retos. La gestión en ciencia y tecnología significa tomar decisiones diarias de cómo utilizar los recursos para alcanzar los objetivos.
También se entremezclan en la coordinación de un centro de investigación.
Sí. Siempre he coordinado proyectos grandes, empezando por la primera ronda de proyectos temáticos financiados por la FAPESP ni bien terminé el doctorado, en 1988, y volví a Inglaterra. Logramos equipar el laboratorio gracias a eso. Después vinieron otros proyectos en red, porque nuestra área es muy interdisciplinaria. Estamos en el Instituto de Física, pero necesitamos la biología, la computación, la química. Al principio era fundamental la colaboración con grupos que produjeran las proteínas para que las estudiáramos.
¿El Cepid requiere mucho esfuerzo de gestión?
Somos 22 investigadores principales, además de los alumnos, y tenemos apoyo administrativo. Uno de los desafíos de coordinar un proyecto como ese es integrar a los investigadores. Como son todos buenos e independientes, hay que convencerlos de que vale la pena colaborar los unos con los otros. Si cada uno sigue haciendo solo sus tareas, tendremos una buena lista de publicaciones para el informe. Pero el foco del CIBFar es en fármaco y Brasil no tiene una historia de innovación en esa área. Tiene que estar el biólogo, el biólogo estructural –que estudia la estructura de las moléculas– y el químico. Y alguien que esté mirando el todo, el coordinador. No entro más al laboratorio para ocuparme de tubos de ensayo, pero entro todos los días.
De la investigación a la producción, ¿qué hace falta?
La industria farmacéutica nacional está muy bien guarnecida en la parte de formulación, de producción. Con la legislación que reguló los genéricos, hubo que aprender a hacer fármacos con calificación. Ahora, el desafío es innovar. El fármaco necesita encontrar un receptor para encajarse de tal manera que produzca determinado efecto, que es activar o desactivar alguna proteína. Encontrar una molécula no es fácil: tenemos en nuestro cuerpo miles de proteínas, con miles de estructuras diferentes. Los efectos colaterales en general ocurren cuando las moléculas de un fármaco se adhieren a cosas que encuentran por el camino. Lograr domesticar una molécula que recorra todo el organismo hasta su blanco es un arte que implica ensayo y error, con síntesis de moléculas diferentes.
No existía un lugar en el que se pudiera estudiar una sustancia promisora de forma integrada
¿Cada enfermedad funciona de una forma?
Para los microorganismos, es necesario determinar la proteína esencial a su supervivencia, a fin de que tengamos una diana validada. Mucha gente estudia los microorganismos causadores de enfermedades, la forma como producen síntomas, se conectan en la célula que quieren invadir, inyectan el ella material genético o proteínas. Siempre trabajé con la enfermedad de Chagas, la esquistosomiasis, la leishmaniosis, y otros colegas quedaron a cargo cuando estuve en el CNPq, entre 2011 y 2015. Cuando volví, fue el momento en el que ocurrió la epidemia de zika, fiebre amarilla y chikunguña. Algunas décadas atrás el proceso era muy experimental y se daba por hallazgos fortuitos. Cambió cuando entendimos mejor la biología de las enfermedades y empezamos a estudiar la estructura de las proteínas que interactúan con ellas.
Se necesita una multitud para cubrir la cadena de conocimiento. ¿Falta gente?
Falta encadenamiento. Tenemos un investigador que entiende de farmacocinética en ratas, otro que hace toxicología, otros que estudian la biología fundamental de las enfermedades, que trabajan con la estructura de las proteínas o síntesis química. Pero se necesita una orquesta. Si cada uno se preocupa solo son su sonido, nunca tendremos un sinfónica. La ciencia brasileña todavía es sumamente disciplinaria. En las universidades, los departamentos son separados. Las carreras de grado son estancas, no hay oportunidad de tomar a un alumno que entienda la física para usar un rayo X y técnicas biofísicas de fluorescencia y al mismo tiempo sepa qué es una bacteria, cómo es la biología molecular de clonar un gen.
¿El CIBFar es una evolución de lo anterior?
Presentamos la primera propuesta en 1998, en la primera convocatoria del Cepid. El programa nació porque le dijimos a José Fernando Perez, en ese entonces director científico de la FAPESP, que la ciencia moderna es multidisciplinaria. Me di cuenta de eso porque en 1996 estábamos trabajando con la enfermedad de Chagas, un proyecto temático que nos permitió construir una línea de luz en el LNLS [el Laboratorio Nacional de Luz Sincrotrón] para analizar la estructura de las proteínas. Para eso hace falta tener cristales, donde los átomos se ordenan. Pero en un cristal de 1 décimo de milímetro son 1013 moléculas de proteína: 1 seguido de 13 ceros, varios billones de moléculas que necesitan ser ordenadas; da cierto trabajo. Entonces conocí, en un congreso, a un bioquímico estadounidense de la Universidad de Alabama en Birmingham, Lawrence DeLucas, que era astronauta y trabajaba para la Nasa [agencia espacial estadounidense] en un proyecto de cristalización de proteína en microgravedad (en esa condición es posible obtener cristales con más facilidad). Él me invitó a hacer un experimento en la Estación Espacial Internacional. Fue el primer experimento brasileño realizado en el espacio, lanzado en el transbordador espacial Columbia en 1997. A la vuelta del lanzamiento, fui a visitar el laboratorio en Birmingham, un centro de la National Science Foundation [NSF]. Ellos tenían centros de investigación con ese papel multidisciplinario y mi colega estaba al frente de uno de ellos, con biólogos, químicos, gente del área de computación, de cristalografía y de fármacos, trabajando de forma integrada y en interacción con empresas. Sugerí que tuviéramos algo parecido y el profesor Perez hizo un viaje a Estados Unidos para visitar algunos centros de la NSF. Cuando volvió, lanzó la convocatoria. Nuestro desafío, en el proyecto que presentamos, era crear en el país una masa crítica en estructura de materiales biológicos. Nadie producía proteínas puras aquí. Teníamos 15 biólogos moleculares y biólogos, y dos químicos. Hoy en día el reto del fármaco es la química y en el centro actual hemos invertido la ecuación: tenemos 15 químicos y dos o tres biólogos estructurales.
Y la “biodiversidad”, que está en el nombre del CIBFar, ¿dónde se encaja?
Se encaja como fuente de inspiración de moléculas activas. El fármaco no puede ser muy polar, porque si lo es no atraviesa ninguna membrana; no puede ser muy hidrófobo, de lo contrario no es soluble; no puede ser muy lábil, si no se rompe; al mismo tiempo no puede ser muy grande, si no se pega a otras cosas. Una planta no corre, no grita, está parada; la única defensa que tiene contra los hongos, insectos bacterias fitopatogénicas es química. Las rutas biosintéticas que hacen esas moléculas han sido seleccionadas a lo largo de miles de millones de años de evolución, han sido domesticadas para interactuar con otros organismos vivos. A partir de ellas, es posible hacer modificaciones para optimizar su acción y simplificar la química. Después podemos probar propiedades in vitro, sin necesidad de animales. No existía un lugar en el que se pudiera estudiar una sustancia promisora de forma tan integrada. Ese es lo que hace el CIBFar.

Archivo personal
José Fernando Perez, Francisco Landi (en esa época directores de la FAPESP), Flávio Fava de Moraes (en esa época rector de la USP) y Oliva en el lanzamiento del experimento a bordo del Columbia, en 1997Archivo personal¿Hay resultados que se destacan?
Recientemente encontramos un conjunto de moléculas para combatir la malaria, en un proyecto coordinado por mi colega Rafael Guido. La patente todavía está en preparación. Son moléculas sumamente potentes, con propiedades farmacocinéticas promisoras, que matan al parásito in vitro e in vivo en experimentos con ratoncitos. Despertaron el interés de GlaxoSmithKline, empresa farmacéutica internacional que nos contactó por intermedio de la FAPESP. Las moléculas se transfirieron al centro de desarrollo de Glaxo en Tres Cantos, en España, por medio de un convenio, y en este momento pasan por pruebas que no se hacen en Brasil. otro ejemplo descubierto por miembros del Cepid en la Universidad Federal de São Carlos es una molécula natural 10-gingerol, extraída del jengibre, que se mostró eficaz para impedir metástasis en cáncer de mama. Tenemos moléculas nuevas contra la fiebre amarilla, por ejemplo, con una potencia muy grande aún no descrita en la literatura. Son resultados promisores. En los seis primeros años del Cepid trajimos a personas de las diferentes áreas para trabajar juntas. Ahora la estructura está armada y es hora de entregar los resultados.
Ustedes usan luz sincrotrón para dilucidar la estructura de las proteínas. Ahora entra una nueva generación de aceleradores de partículas, con Sirius. ¿Qué cambia?
Cambia mucho. En mi doctorado, en 1987, demoré un fin de semana para recolectar un conjunto de datos de difracción de rayos X para una proteína y seis meses para procesar y analizar las 600 planchas fotográficas. Hoy mandamos tanques de nitrógeno líquido con cristales de proteínas al acelerador Diamond, en Inglaterra. Cada recolección de datos demora cerca de 30 segundos. El Sirius va a permitir el aumento de la resolución de la difracción por rayos X, va a cambiar el estándar, usando cristales mucho más pequeños y generando análisis mucho más rápidos que las alternativas que tenemos aquí y en el mundo.
Usted se graduó en ingeniería. ¿Se imaginaba otra trayectoria profesional?
Fue una casualidad. Elegí ingeniería eléctrica, pero a fines de primer año un profesor que me dio clases de física me convocó a ayudar a construir un sistema de vacío para unos experimentos, durante las vacaciones. El profesor Sérgio Mascarenhas era el líder del laboratorio de biofísica, siempre inspirador, motivador. Cursé como oyente su asignatura de introducción a la historia de la física y me encantó. En el segundo semestre de 1978, él había regresado de Inglaterra y me mostró una caja con la cual no sabía qué hacer. Era un conjunto de piezas que representaban átomos de una molécula de mioglobina, pero él había perdido las instrucciones y me preguntó si yo quería armar el modelo. Me llevó seis meses y me di cuenta de que aquello era lo que yo quería hacer.
¿Cómo hizo para convertirse en físico?
Durante el segundo año de ingeniería, decidí hacer otro examen de ingreso. En aquellos tiempos era posible cursar dos carreras a la vez. Los dos cursados eran a la mañana, pero yo me adaptaba. Ya estaba ultracomprometido en el laboratorio de la química Yvonne Mascarenhas y del físico Eduardo Castellano, un argentino que huyó de la represión en su país, que hacía difracción de rayos X en moléculas pequeñas. Nadie hacía estructura de proteína en el país. Cuando terminé ingeniería, un profesor titular de la carrera de física –Aldo Craievich– se trasladó al Centro Brasileño de Investigaciones Físicas, en Río de Janeiro. En aquella época, 1981, no existía concurso público para la admisión de profesores y el consejo departamental decidió contratar a cuatro docentes para substituir a Craievich, como auxiliares de enseñanza: Vanderlei Bagnato, que coordina otro Cepid y es el director del Instituto de Física; José Nelson Onuchic, actualmente miembro de la Academia Nacional de Ciencias de Estados Unidos; Carlos Antonio Ruggiero; y yo. Carlos Antonio y yo todavía no teníamos diploma. Los demás se habían graduado el año anterior y los contrataron inmediatamente. Por eso, mi contrato con la USP como docente tiene la fecha del 18 de diciembre de 1981, el día que me gradué.
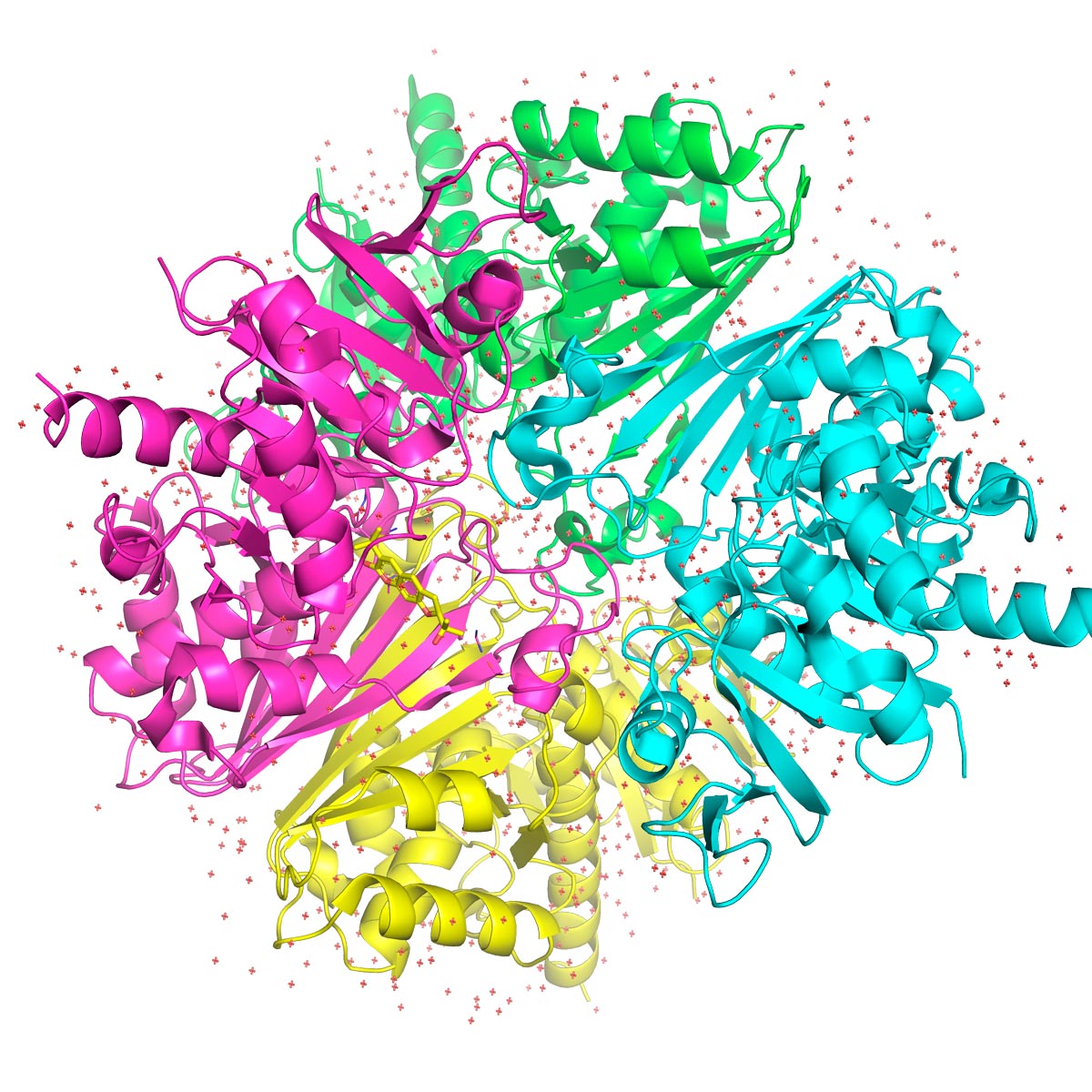
CIBFar
Modelos complejos de moléculas hoy son generados por computadora; aquí, la proteína GAPDH de Trypanosoma cruzi CIBFar¿Terminó la carrera de física?
A principios de 1982 fui a inscribirme y me dijeron que no podía ser alumno siendo docente del mismo instituto. Entonces me anoté en la maestría, hice estructura de moléculas pequeñas. Fue la preparación para que pudiera hacer estructura de proteínas, que era lo que yo quería hacer desde siempre, y fui a cursar el doctorado en la Universidad de Londres, en Inglaterra, con Tom Blundell, un referente internacional en estructura de proteínas. Durante cuatro años estudié tres proteínas: un péptido pequeño, otro mediano y una proteína bastante grande asociada a enfermedades neurodegenerativas, como el mal de Alzheimer y la amiloidosis. Fue esa la que me llevó seis meses entre la recolección y el procesamiento de datos. Para resolver la estructura fueron dos años más; me rindió un artículo en 1994 en Nature.
De regreso a Brasil, ¿cómo continuó?
No existía una estructura que mezclara laboratorios de preparación de proteínas, de cristalización y de rayos X. Cuando llegué, el director Oscar Hipólito me dijo que tenía un laboratorio para mí. Era una sala con una pileta cubierta de azulejos blancos. En general los laboratorios de física no tienen pileta, pero él ele pensó que hacía falta agua para trabajar con estructura de proteínas. No se necesita agua para trabajar con laser, hasta estorba. Fue un desafío, empezamos pidiendo proteínas en los laboratorios de otras personas. Todo era muy artesanal y no había material adecuado para trabajar. Teníamos que ser creativos.
¿Cómo fue la elección de rector en la que usted fue el más votado, pero no nombrado?
En 2006 me eligieron director del instituto. Conversando con la rectora Suely Vilella [2005-2009] vi que ella se la pasaba resolviendo problemas del cotidiano –dinero, licitaciones, comedor estudiantil–, pero teníamos problemas fundamentales que pensar: hacia dónde iba la USP, cómo podríamos repensar la carrera de grado… No existía una instancia para pensar la USP en el mediano y largo plazos. Entonces descubrí que en el estatuto de la USP, de 1988, estaba prevista una comisión de planificación. Hablé con la rectora y a finales de 2007 ella nombró esa comisión, que yo presidí. Hacíamos reuniones que duraban todo el día cada mes, más o menos. Nos íbamos a alguna unidad –Piracicaba, São Carlos, São Paulo– y teníamos todo el día para discutir temas centrales. Trajimos gente del exterior para hablar sobre estructura departamental y sobre la carrera de grado, si la universidad tenía que ser de investigación o de enseñanza, si todas tenían que tener el mismo modelo. Ese proceso generó hasta un libro, llamado USP 2034 – Planejando o futuro. Ese año, cuando llegaron las elecciones para rector, nos dimos cuenta que aquello se tenía que materializar en una universidad para el futuro y surgió la idea de tener un candidato a rector. En los primeros meses de 2009, tradujimos aquello en un proyecto de gestión. En junio yo era candidato. A la comunidad universitaria le gustó tener un proyecto construido por tanta gente. Fui el más votado en primera y segunda vueltas. Pero el entonces gobernador José Serra eligió a Grandino Rodas.
Entonces vino el CNPq.
Yo era el director del Instituto de Física, todavía me quedaban seis meses de mandato, pero quedó una situación incómoda. El director tiene asiento en el Consejo Universitario. Sería malo para mí y para Rodas, como rector. En 2010, nombraron a un colega físico de Río, Carlos Aragão, presidente del CNPq y él me invitó a ser director. A fines de aquel año, Aragão salió, coincidentemente con el cambio de gobierno. Dilma Rousseff asumió como presidenta y Aloizio Mercadante, como ministro, quien me terminó nombrando presidente de la institución.
Cambiamos la carrera de grado en el instituto para sacar al alumno del aula y ponerlo a trabajar
Después de ser contemplado en la primera convocatoria de los Institutos Nacionales de Ciencia y Tecnología, los INCT, usted ha visto el programa desde el otro lado. ¿Cómo lo ve?
Teníamos 120 INCT financiados desde 2008. Estaba previsto en el pliego que debería haber una evaluación. En 2010, y luego en 2013, hicimos eventos de tres días en los que los coordinadores de todos los INCT, a veces una o dos personas más, se iban a Brasilia. Cada uno de ellos tenía un stand en el que tenía que mostrar de forma visual qué hacía. Traíamos gente de la ciudad, del gobierno, del congreso para ver qué se estaba produciendo. Venía un comité internacional, alrededor de 20 personas. Organizábamos un simposio dividido en temas, en el que cada INCT tenía una hora de presentación y argumentación ante todos los demás de la misma área. Era excelente, los INCT se conocían, gente de fuera veía lo que hacían. El costo-beneficio era muy bueno.
¿Permitía pensar de manera más amplia?
Sí, pero una de las cosas que más me gustó hacer fueron las convocatorias temáticas. Yo quería transformar al CNPq, de una agencia de fomento del Ministerio de Ciencia y Tecnología, en una agencia de fomento del Estado brasileño. Los directores que trabajaban conmigo tenían que ir a los ministerios a buscar problemas por resolver. Nosotros poníamos un poquito de dinero, ellos un montón y lanzábamos convocatorias como temas aplicados. Por ejemplo, tecnologías constructivas para el programa “Mi casa, mi vida”, tecnologías adecuadas a pequeñas propiedades rurales, salud (como el problema del dengue). Los ministerios ponían dinero. Hice convocatorias con la Petrobras para proyectos de petróleo y gas, con la Vale. Las empresas invertían.
¿El rol era organizar?
No solo eso. El CNPq tiene los instrumentos y puede conceder becas, por ejemplo. La comunidad científica está lista para resolver las necesidades del país. Nos dicen que somos alienados que viven dentro de los muros de la universidad, preocupados con nuestro propio ombligo, con el paper por publicar. No es así. Si se lo solicitan, el científico contribuye para la sociedad. Si no lo llaman, se concentra en lo que exigen las agencias de fomento.
¿Cómo surgió el Ciencias sin Fronteras?
Cuando llegué al CNPq, solo tenía 500 becas en el exterior para ofrecer por año. ¿Cómo vamos a vivir con una ciencia así de provinciana? Aquel año, Obama vino a visitar Brasil y le mencionó a Dilma que había lanzado en Estados Unidos el programa 100.000 Initiative, que estimulaba a las universidades estadunidense a enviar a 100 mil estudiantes a conocer el mundo. Eso se llama la diplomacia de la ciencia: cuando se manda a un estudiante al exterior y él convive con aquella comunidad, se crea una red de gente altamente calificada que más tarde termina generando valores mucho más allá de los educativos. La presidenta Dilma decidió hacerlo también y propusimos que lo dominante fueran las becas de posgrado, pero la demanda fue bajísima. Nuestros estudiantes estaban en una zona de confort exagerada. Si entró al doctorado, va a salir con el título. Tenía beca, empleo en Brasil. No había estímulo para salir.
A los del nivel de grado les pareció perfecto.
Sí. El gran villano de la estructura de la ciencia brasileña es el nivel de grado, con ese sistema compartimentado en el que las asignaturas no conversan entre sí, las carreras tampoco. Las carreras de grado son absolutamente centradas en las clases. Es típico que un alumno de ingeniería tenga 35 o 40 crédito de clases en un semestre.
¿No hay tiempo para ser creativo?
El estudiante se la pasa sentado mirando al profesor, que escribe en la pizarra. Cuando este dice que modernizó la clase, es porque cambió las láminas por el PowerPoint. Yo insistía en que necesitábamos modernizar el nivel de grado en Brasil. Ninguna carrera en el exterior tiene más de 15 o 16 horas de clase a la semana. El estudiante va a la biblioteca porque tiene que entregar informes, la exigencia es alta. Aquí, la moneda de contratación del docente en la universidad es la clase. Cuantas más asignaturas haya, más profesores se podrán contratar. Al final, hay una carga didáctica hinchada, y las personas no se relacionan con la creatividad, con la innovación. El alumno es pasivo durante toda la carrera y se le exige que al día siguiente de graduarse se consiga un empleo y vaya a ser innovador en una empresa. No tenemos innovación en las empresas brasileñas porque los alumnos no han sido entrenados para innovar. Mandándolos al exterior, podrían empezar a revolucionar esas carreras contando lo que aprendieron allá fuera. Fue un programa caro, no tengo dudas. Pero llevamos a 100 mil estudiantes al exterior.
¿Qué ha traído de vuelta a la universidad de esa experiencia?
Me empeñé, con otros colegas, en cambiar la carrera de grado en física. Tenemos tres carreras en el instituto: física tradicional, física computacional y ciencias físicas biomoleculares. Eran bastante estancas, no se comunicaban, entonces unificamos el primer año, redujimos la carga didáctica obligatoria al 50% de lo que es la carga exigida. El 50% restante los alumnos lo pueden construir con actividades optativas de cualquiera de esas carreras, pero también de otras unidades del campus. El trabajo de conclusión de la iniciación científica cuenta como crédito en la carrera de grado. Nuestro objetivo es sacar al alumno de dentro del aula y ponerlo a trabajar. Estamos en el segundo año de esas carreras así. Yo ahora estoy en una nueva etapa de mi vida: presenté mi pedido de jubilación. No cambia nada, sigo como profesor sénior tiempo completo, con este laboratorio y proyecto de investigación, con mis alumnos de posgrado, dando clases en el nivel de grado. Lo único que no puedo hacer es participar de las reuniones de consejo y de congregación.
Ni ser rector.
Así dejan de llamarme cada vez que hay una elección para rector preguntándome si voy a ser candidato. Honestamente, quiero estar cerca de mis dos nietitas, una de 1 año y la otra de 5.


