Algunos expertos consideran al hambre y la saciedad como los extremos de un estado fisiológico que controla la búsqueda de la energía esencial para mantener al organismo vivo y funcionando en equilibrio. Al igual que los platos de una balanza, el deseo de comer y la sensación de satisfacción oscilan a lo largo del día, regulados por una serie de sustancias producidas por el sistema digestivo y el tejido adiposo que informan al sistema nervioso central sobre la disponibilidad de energía o la necesidad de buscar alimento. En el cerebro, lo que gobierna los momentos de hambre y saciedad es una estructura profunda y polivalente: el hipotálamo. Con un tamaño menor a una almendra y una morfología similar a un cono, el hipotálamo funciona como una especie de celador central del cuerpo. Además de controlar el deseo de comer, regula directa o indirectamente la temperatura, la sed, la fatiga, el sueño, la construcción de vínculos con otras personas y la libido.
Los estudios publicados este año por dos grupos brasileños están ayudando a identificar algunas piezas del tablero bioquímico del hipotálamo que influyen en las sensaciones de hambre y saciedad, cuya acción había pasado desapercibida para la ciencia. Una de ellas, incluso parece erigirse como un blanco potencial para la acción de los medicamentos prescritos para controlar el aumento exagerado de peso, un problema que ha adquirido dimensiones planetarias en las últimas décadas. Hoy en día, el sobrepeso y la obesidad afectan a poco más de la mitad de la población mundial, razón por la cual esta epidemia ha sido apodada “globesidad”.
En experimentos con ratones realizados en la Universidad de Campinas (Unicamp), el equipo del inmunólogo Lício Velloso constató que el aumento de la expresión de un solo gen, activo en el cerebro en tan solo una cantidad reducida de células del hipotálamo, puede ser suficiente como para disminuir el aumento de peso al estimular la saciedad y el gasto energético, además de moderar los síntomas de la ansiedad y la depresión, habituales en una parte importante de las personas con sobrepeso y obesidad. En la Universidad de São Paulo (USP), el fisiólogo José Donato Junior y sus colaboradores también comprobaron, en experimentos con roedores, que una hormona llamada grelina, producida en el sistema digestivo y tradicionalmente asociada al despertar del hambre, no actúa sola. Requiere de la acción simultánea de otro compuesto –la hormona del crecimiento, durante décadas vinculada solamente con los fenómenos que elevan el consumo de energía– para desencadenar en el hipotálamo el impulso de búsqueda de alimentos.

Rodrigo Carraro / Unicamp
Imagen de microscopía de las células del tejido adiposo, más pequeñas y menos numerosas en los animales con el gen NHLH2 más activo (a la der.) que las del grupo de controlRodrigo Carraro / UnicampEstos estudios, sumados a otros llevados a cabo en Brasil y en el exterior, ayudan a entender cuán intrincada es la relación entre las piezas del mecanismo que controla la saciedad y el hambre y lo difícil que resulta alterar su funcionamiento sin causar daños mayores. “Los mecanismos que controlan el equilibrio energético son redundantes y complejos”, dice el bioquímico Marcio Torsoni, de la Unicamp, quien no participó en ninguno de los dos estudios. “Por esta razón, cualquier interferencia hormonal para el tratamiento de la obesidad solo puede practicarse tras una comprensión perfecta de cómo afecta cada hormona la señalización celular y sus repercusiones sobre otros eventos metabólicos y conductuales”, añade.
Una característica peculiar hace del gen estudiado por el grupo de Velloso un buen blanco para la acción de los fármacos contra el aumento de peso. Con un nombre complicado, atribuido en función de las características estructurales de la proteína que codifica y de la función que ella ejerce, el gen nescient helix-loop-helix 2 (NHLH2) se expresa normalmente en un grupo muy limitado de células del hipotálamo: las neuronas productoras de proopiomelanocortina, conocidas por las siglas POMC. Cuando están saturadas de grasas, las células del tejido adiposo distribuidas por el cuerpo liberan en el torrente sanguíneo la hormona leptina que, al llegar al cerebro, le indica que es el momento de dejar de comer. En el hipotálamo, la leptina activa a las neuronas POMC y estas, a su vez, liberan un neurotransmisor que activa a otras neuronas e inducen la saciedad.
El aumento de la expresión del gen NHLH2 redujo el aumento de peso y elevó el gasto energético
Desde hace más de dos décadas se sabe que el NHLH2 tiene alguna conexión con el aumento de peso en los animales y en los seres humanos. En 1997, en un estudio cuya intención fue descubrir la función de este gen, la biomédica Deborah Good, durante una pasantía posdoctoral en el Instituto Nacional del Cáncer de Estados Unidos, desactivó las dos copias del gen en embriones de ratones y observó lo que ocurría. Sin el NHLH2, los roedores no desarrollaban bien sus órganos sexuales, perdían la libido y en la adultez se volvían obesos. Años después, también verificó que esos animales eran menos activos que lo normal.
“Esos y otros estudios que redujeron la expresión del gen o lo desactivaron demostraron que el cuadro de obesidad empeoraba”, relata Velloso, coordinador del Centro de Investigaciones en Obesidad y Comorbilidades (OCRC) uno de los centros de investigación, innovación y difusión (Cepid) financiados por la FAPESP. “Quedó claro que era importante para la regulación del peso, pero todavía no se había intentado comprobar qué ocurre cuando se aumenta su actividad”, explica el inmunólogo.
Rodrigo Carraro / Unicamp
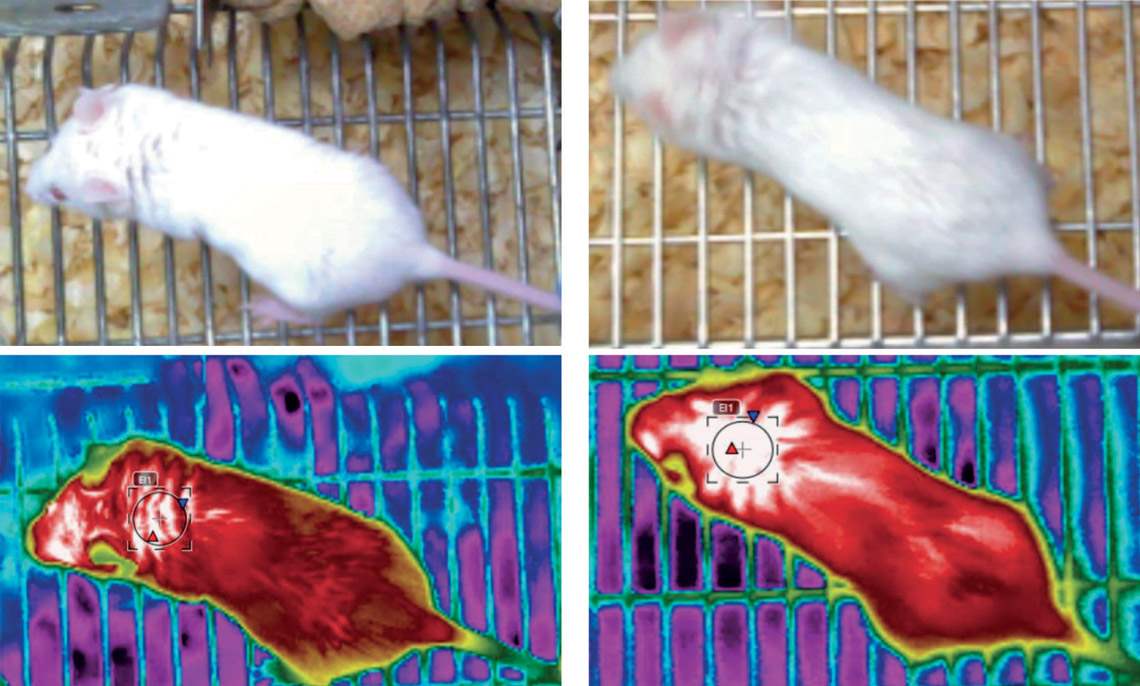
Los ratones con el gen NHLH2 más expresado (a la der.) presentaban una temperatura corporal (medida en la zona de la nuca) alrededor de 1,3 ºC más alta que los animales del grupo de controlRodrigo Carraro / UnicampDurante su doctorado bajo la supervisión de Velloso en el Laboratorio de Señalización Celular de la Unicamp, el biólogo Rodrigo Carraro utilizó un virus modificado genéticamente para elevar un 40 % la expresión del gen en las neuronas POMC. Para resumirlo, una expresión mayor de este gen generó un efecto preventivo y otro curativo. En los animales cuyo peso era óptimo al comienzo de los test y fueron alimentados con una dieta abundante en grasas (hiperlipídica), inductora de obesidad, el aumento de la actividad del NHLH2 evitó que se volvieran obesos al elevar el nivel de saciedad. Los roedores que producían una cantidad mayor de la proteína codificada por el gen comían menos que aquellos con una actividad normal del NHLH2 y engordaban aproximadamente un 40 % menos, según indican los resultados publicado a finales de octubre en la revista Journal of Neuroscience.
En los ratones que ya iniciaron el experimento siendo obesos, el efecto fue aún mayor. También alimentados con una dieta hiperlipídica, aumentaron un 80 % menos peso que los del grupo de control. Y también gastaron un 15 % más de energía al ser físicamente más activos, produjeron más calor en su tejido adiposo pardo. Caminaban más en las jaulas y soportaban por más tiempo el ejercicio en la cinta o en un cilindro giratorio. Su temperatura corporal también fue, en promedio, 1,3 grados Celsius (ºC) más alta que la de los animales con actividad del gen normal: la temperatura media del primer grupo fue de 34,3 ºC, en comparación con los 33 ºC del segundo grupo. En las baterías de experimentos conductuales, los ratones que sintetizaban más proteína codificada por el NHLH2 exhibieron menos síntomas de depresión y ansiedad.
“Todavía no se había atribuido a este gen funciones tan importantes como el control del hambre y la disminución de la depresión y la ansiedad”, dice Velloso. Si se logran identificar compuestos capaces de aumentar la expresión del NHLH2 en el hipotálamo, los que más podrían beneficiarse con un posible tratamiento serían los obesos ansiosos, estiman los investigadores, debido a que estos individuos son más sensibles a alteraciones mínimas en el ambiente o en su rutina, lo que los lleva a buscar comida incluso cuando no tienen hambre.
La acción de la grelina, llamada la hormona del hambre, es insuficiente para despertar el apetito
“El hipotálamo controla una infinidad de procesos fisiológicos a nivel periférico y central, y está interconectado con áreas cerebrales vinculadas, entre otras cosas, al comportamiento. El vínculo entre obesidad y ansiedad o depresión es muy conocido en los humanos y está asociado al acto de comer en exceso. Esta investigación provee una nueva base molecular, hasta ahora desconocida, para esta asociación”, comenta el fisiólogo Miguel Antonio Lopez, de la Universidad de Santiago de Compostela, en España, quien estudia el rol de las neuronas del hipotálamo en la percepción de los niveles de energía del cuerpo.
El equipo de la Unicamp tiene previsto iniciar ahora un cribado de los compuestos sintetizados para encontrar algunos que tengan afinidad con el gen y eleven su expresión, aumentando la saciedad. Si una de estas moléculas funciona en los seres humanos, podría dar origen a un tratamiento farmacológico con efectos adversos limitados, ya que el NHLH2 se encuentra expresado en una cantidad muy limitada de neuronas. “Este gen es un buen blanco porque se encuentra en la neurona correcta”, dice Velloso.
El equipo de la USP, por su parte, aún no ha tenido la misma suerte de hallar un objetivo tan específico, aunque su trabajo está ayudando a revisar cómo funciona la activación del hambre. Desde el momento en que fue descubierta, en 1999, la grelina ha sido considerada la principal responsable de despertar en el organismo la urgencia de alimentarse, razón por la cual ha sido llamada “la hormona del hambre”. Su producción tiene lugar en el estómago y en los intestinos y actúa sobre otro pequeño grupo de células del hipotálamo: las neuronas AgRP/NPY, denominadas así a causa de los neuropéptidos que las producen. Su efecto es tan potente que, al inyectársela en el torrente sanguíneo, provoca que las personas o animales busquen alimento incluso después de una comida abundante.
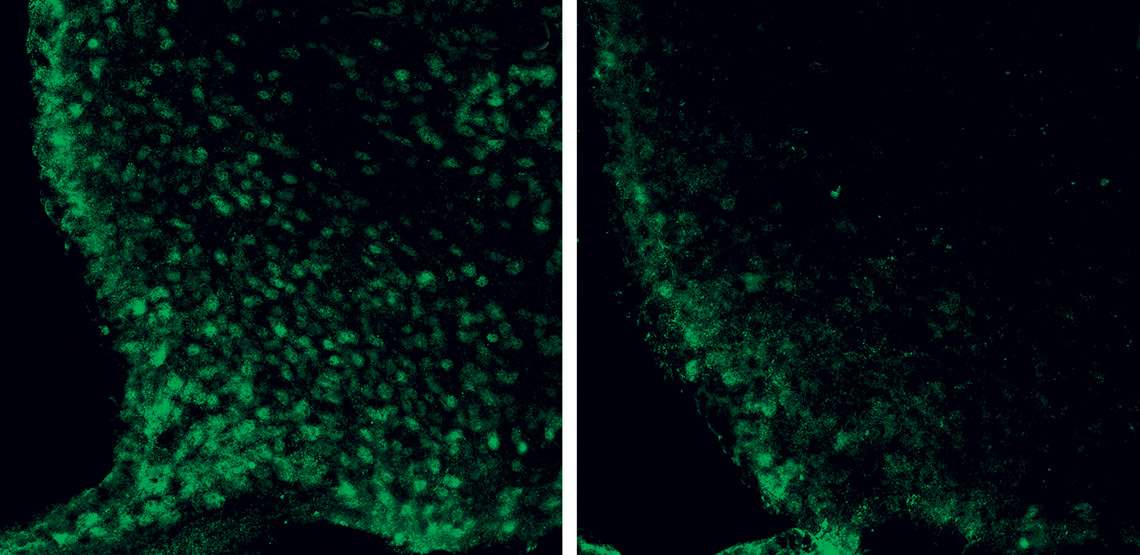
Frederick Wasinski / USP
En la imagen de microscopía pueden verse las neuronas del hipotálamo (los círculos verdes) de ratones con el receptor de la hormona del crecimiento (GH) intacto (a la izq.) y desactivado (a la der.)Frederick Wasinski / USPEl mecanismo de acción de la grelina comenzó a revelarse más complejo tras verificarse hace algunos años que también tiene efecto sobre la hipófisis, una glándula vecina al hipotálamo, estimulando la producción de la hormona del crecimiento (GH, por sus siglas en inglés). Este compuesto estimula en los órganos y tejidos periféricos la proliferación celular y el gasto de energía, induciendo el crecimiento en las primeras fases de la vida y la reparación de tejidos en los adultos. Sin embargo, en 2019, el grupo de la USP descubrió que durante los períodos de ayuno esta hormona también despierta a las neuronas AgRP/NPY generando hambre y, simultáneamente, le indica al cuerpo que es necesario economizar energía (lea en Pesquisa FAPESP, edición nº 277).
“Durante cierto tiempo, se supuso que los efectos de la grelina y de la GH ocurrían simultáneamente y en forma independiente”, dice Donato. El trabajo de su equipo ahora apunta que la acción aislada de la grelina sobre las neuronas AgRP/NPY es insuficiente para generar hambre. Ella depende de la acción simultánea de la GH en el hipotálamo, posiblemente en otro grupo de neuronas.
Esta dependencia empezó a hacerse evidente en los experimentos que llevó a cabo el fisiólogo Frederick Wasinski entre 2016 y 2020, en el marco de una pasantía de posdoctorado supervisada por Donato. En el Laboratorio de Neuroanatomía Funcional de la USP, Wasinski produjo dos tipos de ratones genéticamente alterados, cada uno de ellos con un grado diferente de insensibilidad a la acción de la GH. Las neuronas del cerebro de los ejemplares del primer grupo no disponían de la molécula (el receptor) al cual se une esta hormona. En los del segundo grupo, estos receptores solamente se hallaban ausentes en las neuronas AgRP/NPY. En ambos casos, los roedores seguían siendo capaces de producir normalmente la hormona del crecimiento y consumían proporcionalmente la misma cantidad de alimento que los animales del grupo de control, con sus receptores intactos y activos.
Las diferencias comenzaron a aparecer cuando se realizaron dos pruebas de restricción alimentaria, situación en la que, naturalmente se eleva la producción de grelina y GH. En el primer experimento, los animales permanecieron durante 24 horas sin acceso a la comida, antes de poder volver a comer libremente. En el segundo, se los liberó para que comieran a voluntad luego de cinco días bajo un régimen de restricción alimentaria (recibían el 60 % de las calorías que necesitaban). En ambas condiciones, los animales sin el receptor de la GH en el cerebro comieron más luego del período de privación de alimentos, pero aun así, en un nivel bastante inferior a los del grupo de control. Esto fue señal de que, sin la acción de la hormona del crecimiento, la grelina no despertaba el hambre igual que antes.
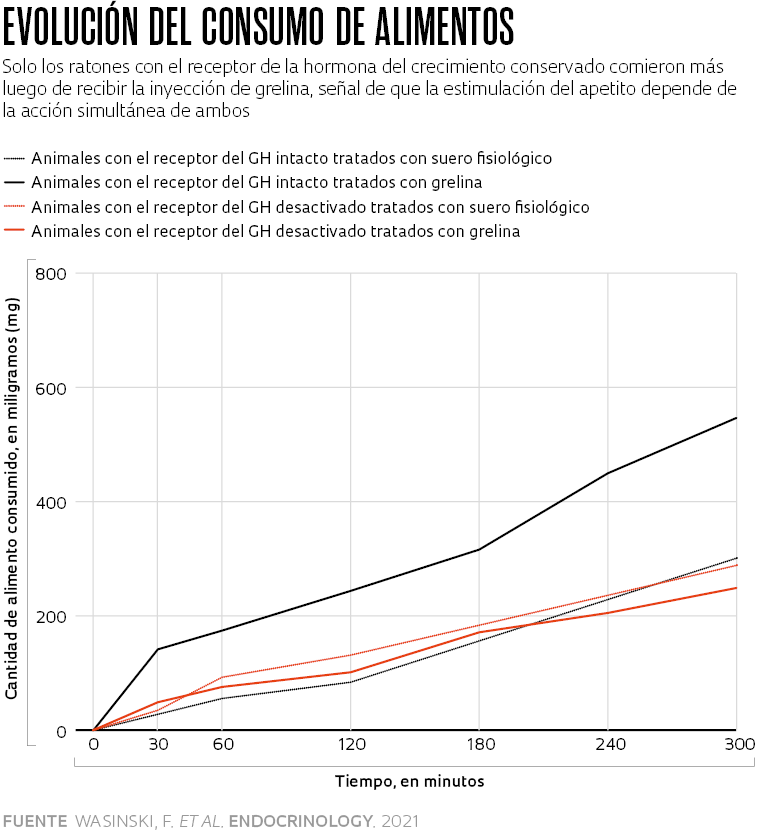
En otra batería de pruebas, Wasinski estimuló el hambre artificialmente (les inoculó una dosis de grelina en el torrente sanguíneo) y constató que los ratones sin el receptor de GH solo en las neuronas AgRP pasaron a comer tanto como los del grupo de control, que conservaban sin alteraciones la señalización de esa hormona en el cerebro. Los ejemplares sin el receptor en la totalidad del cerebro ingerían menos alimentos que los de los otros dos grupos, según los datos publicados en mayo en la revista Endocrinology. Días después, el grupo del endocrinólogo Jeffrey Zigman, del Southwestern Medical Center en la Universidad de Texas (EE. UU.), presentó una conclusión similar en un artículo que salió publicado en la revista Molecular Metabolism, en el que describe sus pruebas con roedores que no producían la hormona del crecimiento porque carecían del receptor de la grelina en la hipófisis.
Según los investigadores de la USP, este resultado sugiere que la estimulación del apetito que promueve la grelina depende de la acción concomitante de la hormona del crecimiento en otros grupos de neuronas del hipotálamo, y no solo en las AgRP/NPY. El equipo de Donato ahora está realizando otras pruebas para tratar de identificar cuáles serían esas neuronas.
“Desde el punto de vista fisiológico, la acción sinérgica de las dos hormonas tiene mucho sentido, ya que el efecto de la hormona del crecimiento depende del aporte de nutrientes energéticos, facilitado por la acción de la grelina al estimular el hambre”, comenta Torsoni, de la Unicamp. “Para identificar cuáles de ellas podrían ser manipuladas por posibles compuestos para tratar la obesidad, es fundamental conocer cómo la interacción de ambas modula la actividad de los distintos grupos de neuronas del hipotálamo”, concluye.
En opinión de Eduardo Ropelle, fisiólogo de la Unicamp quien no fue parte de esta investigación, el hallazgo del grupo de la USP puede dar lugar a nuevas posibilidades terapéuticas para el tratamiento de la obesidad, puesto que los compuestos que inhiben la actividad de la grelina están siendo testeados exhaustivamente en modelos experimentales con resultados modestos y a menudo no concluyentes. “La combinación de compuestos capaces de inhibir selectivamente tanto la actividad de la grelina como de la GH podría dar resultados más prometedores, aunque no se puede desestimar el riesgo de que aparezcan efectos adversos”, dice Ropelle.
Proyectos
1. Análisis de la expresión y distribución de la proteína NHLH2 en el hipotálamo de animales sometidos a una dieta hiperlipídica (nº 16/00977-2); Modalidad Beca doctoral; Investigador responsable Licio Augusto Velloso (Unicamp); Beneficiario Rodrigo Scarpari Carraro; Inversión R$ 129.997,69
2. OCRC – Obesity and Comorbidities Research Center (nº 13/07607-8); Modalidad Centros de Investigación, Innovación y Difusión (Cepids); Investigador responsable Licio Augusto Velloso (Unicamp); Inversión R$ 44.752.532,26
3. El sistema nervioso central como blanco de la hormona del crecimiento para la regulación de múltiples funciones biológicas (nº 20/01318-8); ModalidadProyecto Temático; Investigador responsable José Donato Junior (USP); Inversión R$ 1.839.220,10
4. El papel de las neuronas orexina (hipocretina) como mediadores de los efectos centrales inducidos por la hormona del crecimiento (nº 16/20897-3); Modalidad Beca de posdoctorado; Investigador responsable José Donato Junior (USP); Beneficiario Frederick Wasinski; Inversión R$ 297.822,48
5. Efectos de la hormona del crecimiento sobre las neuronas POMC, colinérgicos y del núcleo paraventricular del hipotálamo: implicaciones en el control del metabolismo energético y glucémico (nº 17/25281-3); Modalidad Beca de posdoctorado; Investigador responsable José Donato Junior (USP); Beneficiaria Paula Gabriele Fernandes Quaresma Bergonsi; Inversión R$ 201.727,01
Artículos científicos
CARRARO, R. S. et al. Arcuate nucleus overexpression of NHLH2 reduces body mass and attenuates obesity-associated anxiety/depression-like behavior. Journal of Neuroscience. 21 oct. 2021.
WASINSKI, F. et al. Ghrelin-induced food intake, but not GH secretion, requires the expression of the GH receptor in the brain of male mice. Endocrinology. 10 may. 2021.
GUPTA, D. et al. Disrupting the ghrelin-growth hormone axis limits ghrelin’s orexigenic but not glucoregulatory actions. Molecular Metabolism. 21 may. 2021.


