Nunca hubo tantas personas que vivieran tanto. Más de la mitad de los bebés que nacen en la actualidad alcanzarán los 65 años y vivirán casi dos décadas o más que la gente que nació a mediados del siglo pasado. El incremento de la longevidad de la población mundial y la disminución de la fertilidad están propiciando que la población mundial envejezca rápidamente. Proyecciones que se desprenden del documento Developing in an ageing world, publicado en 2007 por la Organización de las Naciones Unidas (ONU) indican que en 2050 habrá en el planeta alrededor de 2 mil millones de personas con 60 años o más (un 22% del total), un segmento que en 2005 era de 670 millones de individuos, es decir, el 10% de la población mundial.
El aumento de la expectativa de vida también trae aparejados sus problemas. Uno de ellos es el incremento rápido del porcentaje de ancianos en muchos países, entre los cuales figura Brasil. En Francia, pasaron casi 150 años para que el número relativo de ancianos se elevara del 10% al 20% de la población. En ese lapso, el país se enriqueció y mejoraron las condiciones de vida de las personas. En tanto, China, Brasil y la India transitaron un trayecto similar en 25 años (vea el gráfico).
Hoy en día hay 26 millones de ancianos en Brasil (el 12,5% de su población). Según proyecciones del Instituto Brasileño de Geografía y Estadística (IBGE), en 2050 las personas mayores constituirán el 29% de la población, cuando ese grupo sume 66 millones de individuos. “Brasil está envejeciendo a contramano”, afirma el médico y epidemiólogo carioca Alexandre Kalache, quien durante 13 años fue director del Programa Global de Envejecimiento y Salud de la Organización Mundial de la Salud (OMS) y actualmente preside la filial brasileña del International Longevity Centre (ILC), una organización sin fines de lucro que estudia el envejecimiento poblacional y estrategias de adaptación de los países ante lo que dio en llamarse revolución de la tercera edad. “Tenemos problemas con la salud, el empleo, la educación, el saneamiento y también tendremos que lidiar con una población integrada por una gran cantidad de ancianos”.
Las enfermedades asociadas al envejecimiento se tornarán más comunes, al mismo tiempo que habrá más gente viviendo en forma saludable por más tiempo, algo que modificará el panorama laboral, que exigirá mayor flexibilidad y capacidad de adaptación tanto a personas como a empresas y al Estado. “Las ciudades deberán prepararse para ese nuevo escenario, generando políticas habitacionales, de transporte, participación social, trabajo y educación que tengan en cuenta al anciano”, advierte el epidemiólogo.
En simultáneo con esos cambios, a lo largo del último siglo se produjo un avance jamás visto en la comprensión de las causas del envejecimiento. Una simple búsqueda mediante las palabras clave ageing o aging en una de las mayores y más importantes bases de artículos científicos del área de la salud –Pubmed– detecta alrededor de 384 mil papers publicados sobre el tema entre 1925 y 2016 (vea el gráfico).
En un artículo de revisión publicado en 2013 en la revista Cell, intitulado The hallmarks of aging, investigadores de España y de Francia ofrecen una síntesis de lo que se sabe al respecto de los mecanismos celulares y moleculares –las causas más profundas– del envejecimiento. Este artículo revisa los puntos principales del tema y presenta avances, con la participación de brasileños inclusive.
 Léo Ramos ChavesLos genes y el paso del tiempo
Léo Ramos ChavesLos genes y el paso del tiempo
Una “buena genética” tal vez sea el factor biológico más asociado a la longevidad. Experimentos que implican la manipulación de genes extendieron en forma significativa el tiempo de vida de ciertos organismos considerados modelos, tales como levaduras, moscas, helmintos e incluso mamíferos. La intervención molecular resultó exitosa en el gusano Caenorhabditis elegans, una especie de nemátodo de 1 milímetro de largo cuyo genoma fue secuenciado en 1998. En lugar de durar dos o tres semanas, ese helminto pasó a vivir entre 145 y 190 días luego de que se alteraran sus genes. En el caso del ratón (Mus musculus), acaso el mejor amigo de laboratorio del ser humano, los resultados son más modestos, aunque igualmente positivos. Las intervenciones en su genoma extienden por un año la longevidad del roedor, que normalmente es de casi dos años.
Estos resultados hacen que algunos biólogos moleculares y genetistas defiendan la idea de que la senescencia es un proceso dotado de plasticidad y, en cierta medida, controlable. “Podemos acelerar o retrasar el envejecimiento en los animales”, dice el biólogo portugués João Pedro Magalhães, jefe del Grupo de Genómica Integrada del Envejecimiento de la Universidad de Liverpool, en Inglaterra. “El paso siguiente es lograr eso en seres humanos”. Según Magalhães, los estudios con organismos modelo han identificado a unos 2 mil genes capaces de regular el envejecimiento.
Una de las estrategias de ese empeño por vivir más y mejor consiste en hallar los mecanismos celulares y moleculares asociados a una buena vejez entre aquéllos que son extremadamente longevos. En 2015, Magalhães coordinó la secuenciación del genoma de la ballena de Groenlandia, también llamada ballena boreal o ártica (Balaena mysticetus), el mamífero más resiliente al paso del tiempo. Con una longitud de 18 metros y un peso de 100 toneladas, este cetáceo del Ártico podría contener pistas en su ADN del modo de eludir el cáncer y sobrevivir por dos siglos. Este trabajo, que fue publicado en la revista Cell Reports, apunta alteraciones en un gen ligado a la termorregulación, que podría ser importante para entender el bajo metabolismo del animal. Un ritmo más lento podría explicar de qué manera un mamífero tan grande vive tres veces más que el hombre.
El ADN de los individuos más longevos de nuestra propia especie puede constituir fuente de información útil para combatir enfermedades asociadas a la vejez y contener el avance de las agujas del reloj biológico. Ésta es la expectativa de proyectos ambiciosos como el Wellderly, en el cual se trabaja desde 2007 en el Instituto de Investigación Scripps, de California, EE.UU. En 2016 se publicaron los primeros resultados de peso del proyecto, en cuyo marco se secuenció el genoma completo de 600 ancianos sanos (sin dolencias crónicas), con edades comprendidas entre 80 y 105 años, y los comparó con el de 1.500 adultos más jóvenes.
La diferencia más significativa es que los participantes del Wellderly presentaban un menor riesgo genético de desarrollar problemas cognitivos. En algunos ancianos sanos se identificaron variantes (versiones) del gen COL25A1 que los protegería contra el alzhéimer. También presentaban una propensión pequeña a desarrollar problemas cardíacos, aunque el riesgo genético de tumores, diabetes tipo 2 y derrames fuera igual al del grupo de control.
“Fue sorprendente que no se hallaran diferencias en el riesgo genético para el desarrollo de cánceres”, comenta Ali Torkamani, director de Informática del Genoma y de Descubrimiento de Drogas del Scripps. También sabemos que hay enfermedades genéticas que influyen en la velocidad de la senescencia, generalmente acelerándola. Pero en general, el envejecimiento es un proceso complejo”.
 El Centro de Investigación sobre el Genoma Humano y Células Madre (CEGH-CEL) de la Universidad de São Paulo (USP) coordina un proyecto que va en camino a convertirse en el Wellderly brasileño, con dos poblaciones de ancianos. La primera incluye a más de 1.300 residentes en la ciudad de São Paulo que tenían más de 60 años cuando participaron en el estudio epidemiológico Salud, Bienestar y Envejecimiento (Sabe) realizado a partir de 1999 por la Facultad de Salud Pública de la USP. La segunda, el estudio 80+, abarca el análisis del ADN de alrededor de 130 octogenarios, todos con buena salud.
El Centro de Investigación sobre el Genoma Humano y Células Madre (CEGH-CEL) de la Universidad de São Paulo (USP) coordina un proyecto que va en camino a convertirse en el Wellderly brasileño, con dos poblaciones de ancianos. La primera incluye a más de 1.300 residentes en la ciudad de São Paulo que tenían más de 60 años cuando participaron en el estudio epidemiológico Salud, Bienestar y Envejecimiento (Sabe) realizado a partir de 1999 por la Facultad de Salud Pública de la USP. La segunda, el estudio 80+, abarca el análisis del ADN de alrededor de 130 octogenarios, todos con buena salud.
Los científicos de la USP secuenciaron el exoma, la porción del genoma que codifica proteínas, de los ancianos del Sabe. Los primeros resultados, de 609 participantes, fueron publicados en marzo de 2017 en la revista Human Mutation y evidenciaron la singular composición poblacional (negro, aborigen y europeo) que caracteriza a Brasil. Se hallaron 207 mil variantes genéticas que nunca habían sido descritas en los bancos internacionales de datos moleculares. “Esto revela la importancia de elaborar estudios con nuestra población”, comenta la genetista Mayana Zatz, coautora del estudio y coordinadora del CEGH-CEL, uno de los Centros de Investigación, Innovación y Difusión (Cepid) financiados por la FAPESP. Cada anciano registraba un promedio de 300 alteraciones, en su mayoría inofensivas. Tan sólo siete individuos presentaron mutaciones asociadas a enfermedades, en general, algún tipo de cáncer.
En las próximas semanas, el genetista Michel Naslavsky, del centro de la USP, viajará a Estados Unidos para secuenciar el genoma de 1.300 ancianos del Sabe y del 80+. “Será una labor lenta”, comenta Naslavsky, primer autor del estudio en la Human Mutation. Los datos elaborados por el CEGH-CEL se encuentran disponibles en la página web del Archivo Brasileño Online de Mutaciones (ABraOM).
Las formas de proteger al ADN
Una corriente mayoritaria de biólogos y bioquímicos acepta actualmente la idea de que los organismos envejecen y mueren porque con el tiempo sus células pierden la capacidad de desempeñar funciones, se debilitan y mueren más rápido de lo que pueden ser reemplazadas.
Todo el tiempo, las reacciones químicas en el organismo, sumadas a los fenómenos ambientales, pueden causar lesiones en la molécula de ADN. Experimentos llevados a cabo en los años 1970 por el bioquímico sueco Tomas Lindahl revelaron que el ADN de una célula humana sufre 10 mil pequeñas alteraciones espontáneas por día, casi una cada 10 segundos. En los 3.600 millones de años de existencia de la vida en el planeta surgieron proteínas que ayudan al material genético a mantenerse íntegro, permitiendo que las células produzcan copias perfectas de sí mismas y continúen existiendo.
Como nada es perfecto, los mecanismos de reparación también fallan. En un estudio con ratones publicado en 2007 en la revista Nature, investigadores de Estados Unidos y de Holanda comprobaron que, con el tiempo, las células madre acumulan defectos orgánicos y pierden la capacidad de reproducirse y mantener los tejidos íntegros y en funcionamiento. Estudios posteriores revelaron que con las células humanas ocurre lo mismo, incluso en los síndromes signados por el envejecimiento acelerado, como en el caso de la progeria.
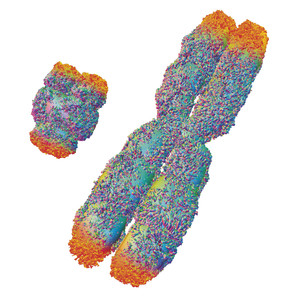
ALFRED PASIEKA/SCIENCE PHOTO LIBRARY
Reproducción artística de dos cromosomas, las estructuras que envuelven el ADN en las células. Los telómeros (en anaranjado) protegen los extremos de los cromosomasALFRED PASIEKA/SCIENCE PHOTO LIBRARYEn el Instituto de Ciencias Biomédicas de la USP, el biólogo molecular Carlos Menck y su equipo estudian la causa de las alteraciones genéticas que impiden la reparación adecuada del material genético. Desde hace algunos años ellos estudian pacientes afectados por la enfermedad hereditaria xeroderma pigmentosum (lea en Pesquisa FAPESP, edición nº 199). Cuando se exponen al sol, éstos desarrollan cáncer de piel con mucha facilidad porque sus células no reparan los daños causados por la radiación ultravioleta. Algunos también pueden presentar problemas neurológicos y otros síntomas parecidos a los observados en los síndromes de envejecimiento acelerado, que en algunos casos conduce a la muerte durante el primer año de vida. Ciertas fallas en esos mismos genes provocan un retraso en el desarrollo físico y mental, característicos del síndrome de Cockayne.
Hace algunos años, Menck inició una colaboración con un exalumno, el biólogo brasileño Alysson Muotri, de la Universidad de California en San Diego, para estudiar los fenómenos que podrían afectar a las neuronas de esas personas. Mediante el agregado de compuestos químicos, indujeron a células de la piel de pacientes con síndrome de Cockayne a regresar a su estadio de células madre, células que son capaces de generar otros tejidos. Luego, las estimularon para transformarse en neuronas, observando que formaban conexiones irregulares con otras células. “Los defectos observados en las neuronas creadas en laboratorio explicarían, al menos parcialmente, el origen de los problemas neurológicos de esos individuos”, comenta Muotri, uno de los autores del artículo publicado en 2016 en la revista Human Molecular Genetics.
Menck y Muotri también verificaron que esas neuronas acumulaban especies reactivas de oxígeno, o radicales libres, compuestos que contienen una forma de oxígeno que interactúa fácilmente con el ADN y las proteínas, dañándolos. Sospechan que eso se produce en versiones defectuosas de las mitocondrias, responsables de la producción de energía en las células. “Creemos que ésta sería la conexión con la progeria, puesto que los niveles elevados de especies reactivas de oxígeno ya han sido relacionados con el envejecimiento”, dice Muotri. “Ahora estamos intentando revertir ese cuadro utilizando compuestos antioxidantes”.
Menck trabaja en la USP para ampliar los daños que ocasionan las especies reactivas de oxígeno en el material genético de los pacientes con síndrome de Cockayne y también para intentar dilucidar qué parte de la maquinaria celular afectan esos daños. En caso de confirmarse que esta estrategia reproduce lo que ocurre en los pacientes con síndrome de Cockayne, Menck y Muotri dispondrán de un modelo de envejecimiento acelerado, útil para comprender lo que ocurre con las personas sanas.
Los problemas con la reparación del ADN también aparecen en otras enfermedades características del envejecimiento como el mal de Alzheimer, más frecuente a partir de los 80 años. En el campus que la USP posee en Ribeirão Preto, la genetista Elza Sakamoto Hojo y su equipo están analizando la eficiencia de la reparación del ADN en personas con y sin alzhéimer. Extrajeron muestras de sangre de 13 personas con edades entre 65 y 90 años que padecían la enfermedad (y de 14 sanas) y sometieron a las células a concentraciones elevadas de especies reactivas de oxígeno –emplearon agua oxigenada–, una coyuntura similar a la que se produciría en el organismo bajo condiciones de estrés. En un artículo publicado en 2013 en International Journal of Molecular Sciences, el grupo revela que las células de las personas con alzhéimer demoran un tiempo tres veces mayor para recuperarse del baño de radicales libres que las de los ancianos sanos.
Telómeros acortados
Durante la vida de la célula, los daños genéticos no se producen en forma uniforme en toda la extensión de la molécula de ADN. Éstos parecen afectar con mayor asiduidad a sus dos extremos, las regiones conocidas con el nombre de telómeros. A estos segmentos del material genético se les atribuye la función de proteger al resto de la hélice de ADN, y algunos comparan su rol con el de la puntera plástica del cordón de los zapatos. Cada vez que el material genético se duplica y la célula se divide, los telómeros se encogen un 2%. Sólo una enzima, la telomerasa, es capaz de recuperar la longitud de los telómeros. No obstante, en los mamíferos, la mayoría de las células adultas no producen telomerasa, generalmente sintetizada por las células madre. Al verse reducida su capacidad de recuperación, los telómeros se acortan conforme avanza la edad. Investigadores de la Universidad Harvard, en Estados Unidos, ya han demostrado que se puede alargar a los telómeros en forma artificial, introduciendo en las células copias extras del gen de la telomerasa. Esta estrategia, sin embargo, puede ser riesgosa, ya que algunos tumores se tornan malignos luego de reactivar la producción de esa enzima.
 En algunas enfermedades, el acortamiento de los telómeros es más rápido. Una de ellas es la disqueratosis congénita, una rara afección que se caracteriza por la dificultad de producir células sanguíneas, epiteliales y del tejido pulmonar, que puede conducir a un envejecimiento acelerado como en el caso de la progeria. Hace tiempo que se sabe que quienes padecen disqueratosis presentan un acortamiento acentuado de los telómeros. El biólogo brasileño Luis Francisco Batista, exalumno de Menck y docente en la Washington University de Saint Louis, en Estados Unidos, confirmó la causa: fallas en el funcionamiento de la telomerasa.
En algunas enfermedades, el acortamiento de los telómeros es más rápido. Una de ellas es la disqueratosis congénita, una rara afección que se caracteriza por la dificultad de producir células sanguíneas, epiteliales y del tejido pulmonar, que puede conducir a un envejecimiento acelerado como en el caso de la progeria. Hace tiempo que se sabe que quienes padecen disqueratosis presentan un acortamiento acentuado de los telómeros. El biólogo brasileño Luis Francisco Batista, exalumno de Menck y docente en la Washington University de Saint Louis, en Estados Unidos, confirmó la causa: fallas en el funcionamiento de la telomerasa.
A partir de las células de la piel de personas con disqueratosis, el investigador generó células madre y comprobó que la enfermedad es más grave cuanto mayor es la incapacidad de producir telomerasa activa. A partir de ese resultado, publicado en 2011 en la revista Nature, Batista se dedicó a estudiar cómo la falta de telomerasa y el acortamiento de los telómeros afectan el stock de células madre de los tejidos. “Estamos intentando descubrir la cadena de eventos que ocurren a continuación”, relata Batista.
Agotamiento sin recuperación
En los ancianos se registra una acumulación de células que alcanzaron el final de su ciclo de vida, perdieron la capacidad de replicar su propio ADN y generar clones de sí mismas. Ese síntoma de la senescencia comporta un aspecto positivo: las células que no se dividen pueden ser eliminadas por el sistema inmunológico, evitando la aparición de tumores.
El problema reside en que también disminuye la capacidad de defensa del organismo ante amenazas externas, tales como virus o bacterias, lo cual puede incidir en la eficiencia de las vacunas. “En Japón, donde hay muchos octogenarios, se está probando con el suministro de tres dosis menores de la vacuna de la gripe en lugar de una sola”, comenta la bióloga Valquiria Bueno, docente de la Escuela Paulista de Medicina de la Universidad Federal de São Paulo (Unifesp).
La bióloga, que estudia la inmunosenescencia, comparó la producción de células defensivas de seis varones y seis mujeres con edades entre 88 y 101 años pertenecientes al Sabe con la de estudiantes de la universidad con menos de 30 años. La generación de leucocitos en la médula ósea, uno de los tipos de células de defensa, fue, en promedio, un 40% menor en los ancianos, un dato similar al registrado en los trabajos internacionales. Más allá de estos hallazgos, presentados en 2016 en el libro intitulado The ageing imune system and health, se observó que en la sangre de esos ancianos longevos también existe un aumento de la producción de otro tipo de células que pueden reducir la resistencia a las infecciones y propiciar el desarrollo del cáncer.
También hay abordajes más polémicos. Experimentos recientes con animales sugieren que el recambio de células viejas por nuevas podría retrasar el envejecimiento o revertir parcialmente el deterioro en ciertos órganos. En algunos de esos estudios se emplea una técnica controvertida concebida a mediados del siglo XIX, la parabiosis, por medio de la cual, un roedor joven es conectado quirúrgicamente con uno viejo con el objetivo de que éste reciba una transfusión de sangre del joven.
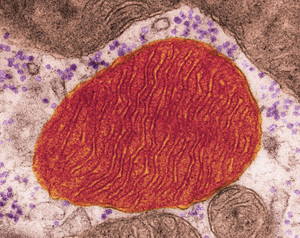
DENNIS KUNKEL MICROSCOPY/ SCIENCE PHOTO LIBRARY
Una mitocondria, orgánulo celular que transforma los nutrientes en energía, en una imagen tomada con un microscopio electrónicoDENNIS KUNKEL MICROSCOPY/ SCIENCE PHOTO LIBRARYEn 2013, el equipo de Amy Wagers, experto en medicina regenerativa de la Universidad Harvard, publicó un artículo en la revista Cell en el cual, por medio de la parabiosis, identificó en ratones viejos que recibieron sangre de animales jóvenes una proteína que combatiría las disfunciones cardíacas ligadas a la vejez. Estudios posteriores reportaron beneficios de ese método en tejidos cerebrales y musculares.
En el mes de noviembre pasado, en un artículo publicado en la revista Nature Communications se informó que el aporte de sangre nueva prácticamente no mejoró los parámetros biológicos de ratones vetustos. En tanto, roedores jóvenes empeoraron al recibir transfusiones de sangre vieja. “Nuestro estudio sugiere que la sangre nueva por sí sola no funcionaría como tratamiento”, dijo al divulgar el trabajo en los medios Irina Conboy, docente de la Universidad de California en Berkeley y autora principal del artículo. “Es más correcto decir que hay inhibidores en la sangre vieja que debemos combatir para revertir el proceso de envejecimiento”.
Daños en las centrales energéticas
Durante mucho tiempo se consideró a las mitocondrias como las villanas del envejecimiento. En 1956, el químico estadounidense Denham Harman propuso que una de las causas de la pérdida de vigor y muerte de las células sería la producción de radicales libres. Por entonces, siendo investigador en la Universidad de California en Berkeley, éste sospechaba que esas moléculas podían interactuar con el ADN, las proteínas y otros componentes de las células, causando estragos. Experimentos posteriores avalaron los argumentos de Harman y condujeron a la recomendación de no practicar ejercicios físicos, que aumentan el consumo de energía y la respiración celular. Hoy en día, la visión es diferente.
En las dos últimas décadas, se llevaron a cabo experimentos que indican que los radicales libres desempeñan una doble función en las células. En concentraciones bajas, inducen la producción de compuestos antioxidantes, protegen a las células del envejecimiento e incluso estimulan su proliferación. Sin embargo, en niveles elevados, desencadenan la muerte celular.
Hacia el final de los años 1970, mientras realizaba una investigación de posdoctorado en la Universidad Johns Hopkins, el médico y bioquímico Aníbal Vercesi notó que determinadas condiciones provocaban la apertura de poros en las membranas de las mitocondrias, matándolas. Más tarde, ya de regreso en la Universidad de Campinas (Unicamp), donde se desempeña como docente, Vercesi constataría que dicho efecto se debe al aumento de la concentración de radicales libres.
En experimentos efectuados con su equipo, el cual estaba integrado por los médicos y bioquímicos Roger Castilho y Alicia Kowaltowski, entonces alumnos de doctorado y hoy docentes en la Unicamp y en la USP, respectivamente, Vercesi verificó que la acumulación de calcio en el interior de las mitocondrias estimula la producción de radicales libres en forma excesiva y provoca daños celulares. Por los poros que aparecen en la membrana de la mitocondria se escapan proteínas, material genético y los propios radicales libres. “Planteamos esa hipótesis en 2001”, relata el bioquímico. “Actualmente es ampliamente aceptada e incluso se la utiliza para explicar los daños que ocurren en el infarto de miocardio y en la isquemia cerebral, además del desarrollo de enfermedades que aparecen con la edad, tales como la diabetes y el alzhéimer.”
La bioquímica Nadja de Souza Pinto, exalumna de doctorado de Vercesi y hoy docente en la USP, estudia las consecuencias de la producción excesiva de radicales libres sobre el ADN de las mitocondrias. Durante el período que trabajó en el Instituto Nacional del Envejecimiento de Estados Unidos, De Souza Pinto estudió el cerebro de pacientes con enfermedad de Alzheimer y notó que la reparación de las lesiones del ADN causadas por radicales libres es menor en aquellos cuyos síntomas son más graves. De regreso a Brasil, la investigadora, el geriatra Wilson Jacob Filho y el gerontólogo José Marcelo Farfel, ambos de la USP, están evaluando la recuperación del ADN mitocondrial en dos grupos: aquéllos afectados por alzhéimer típico y los denominados portadores asintomáticos, que no desarrollan problemas cognitivos. En estudios con ratas, Souza Pinto constató que la reparación del ADN mitocondrial aumenta hasta mediados de la vida del animal y luego decae. “Estamos proponiendo que la baja actividad de esos mecanismos de reparación puede ser un factor de riesgo en el caso del mal de Alzheimer”, comenta.
 Léo Ramos ChavesComer menos y vivir más
Léo Ramos ChavesComer menos y vivir más
El efecto de la alimentación sobre el tiempo de vida de diferentes organismos tal vez sea el tópico relacionado con el envejecimiento que haya sido estudiado por más tiempo. Desde hace casi un siglo se sabe que la reducción de la cantidad de energía consumida por los animales prolonga su tiempo de vida. En 1933, el bioquímico y gerontólogo estadounidense Clive McCay, investigador en la Universidad Cornell, publicó en la revista Science un breve artículo en el cual comparaba la longevidad de las ratas criadas por su grupo, en Nueva York, con la de otras mantenidas en el laboratorio del fisiólogo James Slonaker en la Universidad Stanford, en California.
Los roedores del grupo de McCay, alimentados con una dieta más nutritiva, crecían y alcanzaban la madurez sexual con mayor rapidez. Pero vivían tan sólo la mitad del tiempo que las ratas del laboratorio de Slonaker, que habían ganado peso y madurado con mayor lentitud, viviendo, en promedio, 1.200 días. “Puede que la longevidad y el crecimiento rápido sean incompatibles y que la mejor chance para una vida anormalmente extensa la posean los animales que crecen paulatinamente y alcanzan la madurez más tarde”, sostuvo McCay, planteando la hipótesis de que una ingestión reducida de calorías propiciaría la longevidad, en detrimento de la capacidad reproductiva.
Durante los 50 años posteriores, se comprendió que el envejecimiento es algo inevitable e inherente a la vida. Esta perspectiva comenzó a cambiar en los años 1990, con los hallazgos de la bióloga molecular Cynthia Kenyon, docente de la Universidad de California en San Francisco y actualmente vicepresidenta de investigación sobre el envejecimiento en la empresa Calico, fundada por Google. Kenyon verificó alteraciones en un gen que duplicaban el tiempo de vida del C. elegans sin afectar su fertilidad.
Posteriormente, se descubrió que ese gen codificaba una proteína de la superficie de las células –un receptor– al cual se conectan péptidos similares a la insulina. Luego se comprobó que ese receptor funcionaba como un sensor de nutrientes del ámbito extracelular. “Tales avances generaron una carrera por estudiar la restricción calórica desde el punto de vista molecular”, comenta el biomédico Marcelo Mori, de la Unicamp, que investiga los mecanismos que promueven el aumento del tiempo de vida y se activan mediante la restricción calórica y el ejercicio físico.
Uno de esos mecanismos es la producción de microARNs, moléculas que bloquean el funcionamiento de los genes y la producción de proteínas. En estudios con ratones que comenzó durante su posdoctorado en Harvard y que prosiguió en la Unifesp y en la Unicamp, Mori verificó que la principal fuente de microARNs circulantes en los mamíferos es el tejido adiposo, donde se concentran las reservas de grasa, y que dicha producción disminuye con el envejecimiento. Y también constató, en experimentos con ratones y con C. elegans, que la restricción calórica prolonga el tiempo de vida, al incrementarse la actividad de la enzima Dicer, que transforma moléculas largas de ARN en microARNs (lea en Pesquisa FAPESP, edición nº 212). “El envejecimiento disminuye la producción de Dicer, de microARNs y el tiempo de vida, mientras que la restricción calórica hace lo opuesto”, sostiene Mori.
En la USP, Alicia Kowaltowski y su equipo están interesados en conocer cómo afecta la reducción de la ingestión de calorías sobre el funcionamiento de las mitocondrias. En los animales sometidos a una dieta más restrictiva ellas presentan un formato más alargado, con menores daños y son sustituidas con mayor rapidez que en el caso de aquellos alimentados con una dieta normal, según observaron los investigadores en un artículo publicado este año en la revista Mechanism of Ageing and Development. Experimentos anteriores, presentados en 2016 en la revista Aging Cell, apuntaron que la restricción calórica mejora el funcionamiento de las mitocondrias de las neuronas y las dota de mayor resistencia frente al estrés celular causado, por ejemplo, por el aumento de los niveles de calcio y de radicales libres. Según otro de los autores del grupo, comer menos también mejora el funcionamiento de las células pancreáticas productoras de la hormona insulina, protegiendo contra la diabetes, una de las enfermedades características de la senectud.
Los hallazgos son esperanzadores, pero no se sabe si es posible aplicarlos a la salud de las personas. “Resulta difícil extrapolar los resultados obtenidos en los modelos animales a los seres humanos”, comenta Kowaltowski. En laboratorio, los animales viven protegidos, son sedentarios y se alimentan a voluntad, lo cual los torna obesos en comparación con los que viven en la naturaleza. “En tanto, las personas, aun siendo sedentarias, realizan actividades y no se alimentan permanentemente”, recuerda la investigadora. “En el caso humano, es posible que tan sólo el mantenimiento del peso en niveles que se considera saludables ya sea el equivalente a una restricción calórica en los animales de laboratorio”, dice.
Marcelo Mori, de la Unicamp, imagina que para la mayoría de los seres humanos sería inviable mantener una restricción calórica radical durante toda la vida sin que ello produzca daños en la salud. Para el biomédico, se debe fomentar la búsqueda de intervenciones farmacológicas o dietéticas que mimeticen los efectos de la restricción calórica en forma segura y menos exigente, así como la práctica regular de actividad física, algo que también parece aumentar el tiempo promedio de vida y, tal vez, podría adoptarse con mayor facilidad. “Pese a los avances recientes”, recuerda Mori, “la realidad indica que aún estamos lejos de poder plantear estrategias viables para aumentar la longevidad de los seres humanos”.
Proyectos
1. CEGH-CEL – Centro de Estudios del Genoma Humano y Células Madre (nº 13/ 08028-1); Modalidad Centros de Investigación, Innovación y Difusión (Cepid); Investigadora responsable Mayana Zatz (USP); Inversión R$ 26.897.714,59
2. Consecuencias de las deficiencias de la reparación de lesiones sobre el genoma (nº 14/15982-6); Modalidad Proyecto Temático; Investigador responsable Carlos Frederico Martins Menck (USP); Inversión R$ 2.451.302,99
3. Inestabilidad genómica y vías de señalización molecular implicadas en las respuestas a daños y reparación del ADN (nº 13/09352-7); Modalidad Ayuda a la Investigación – Regular; Investigadora responsable Elza Tiemi Sakamoto Hojo (USP-RP); Inversión R$ 624.252,12
4. Metabolismo energético, estado redox y funcionalidad mitocondrial en la muerte celular y en desórdenes cardiometabólicos y neurodegenerativos (nº 11/50400-0); Modalidad Proyecto Temático; Investigador responsable Aníbal Eugênio Vercesi (Unicamp); Inversión R$ 3.019.922,94
5. Dicer, microARNs y control de la función mitocondrial en el contexto del envejecimiento y de la restricción calórica (nº 15/01316-7); Modalidad Ayuda a la Investigación – Regular; Investigador responsable Marcelo Alves da Silva Mori (Unicamp); Inversión R$ 292.429,97
6. Bioenergética, transporte iónico, balance redox y metabolismo del ADN en las mitocondrias (nº 10/51906-1); Modalidad Proyecto Temático; Investigadora responsable Alicia Juliana Kowaltowski (USP); Inversión R$ 2.210.658,64
7. Estudio de las respuestas celulares a daños en el ADN mitocondrial en células de mamíferos (nº 08/51417-0); Modalidad Ayuda a la Investigación – Regular; Investigadora responsable Nadja Cristhina de Souza Pinto (USP); Inversión R$ 292.654,45
8. Análisis de las células mieloides supresoras en ancianos: población brasileña y británica (nº 14/50261-8); Modalidad Ayuda a la Investigación – Regular; Acuerdo con la Universidad de Birmingham; Investigadora responsable Valquiria Bueno (Unifesp); Inversión R$ 64.197,47
Artículos científicos
LÓPEZ-OTÍN, C. et al. The hallmarks of aging. Cell. 6 jun. 2013.
NASLAVSKY, M. S. et al. Exomic variants of an elderly cohort of Brazilians in the ABraOM database. Human Mutation. 23 mar. 2017.
VESSONI, A. T. et al. Cockayne syndrome-derived neurons display reduced synapse density and altered neural network synchrony. Human Molecular Genetics. 10 ene. 2016.
LEANDRO, G. S. et al. Lymphocytes of patients with Alzheimer’s disease display different DNA damage repair kinetics and expression profiles of DNA repair and stress response genes. International Journal of Molecular Sciences. 10 jun. 2013.
BATISTA, L. F. et al. Telomere shortening and loss of self-renewal in dyskeratosis congenita induced pluripotent stem cells. Nature. 22 may. 2011.
KOWALTOWSKI, A. J., CASTILHO, R. F. e VERCESI, A. E. Mitochondrial permeability transition and oxidative stress. FEBS Letters. 20 abr. 2001.
WEISMANN, L. et al. Defective DNA base excision repair in brain from individuals with Alzheimer’s disease and amnestic mild cognitive impairment. Nucleic Acids Research. v. 35(16). p. 5545-55. 2007.
SOUZA-PINTO, N. C. et al. Age-associated increase in 8-oxo-deoxyguanosine glycosylase/AP lyase activity in rat mitochondria. Nucleic Acids Research. v. 27(8), p. 1935-42. 1999.
LUÉVANO-MARTÍNEZ, L. A. et al. Calorie restriction promotes cardiolipin biosynthesis and distribution between mitochondrial membranes. Mechanisms of Ageing and Development.14 feb. 2017.
AMIGO, I. et al. Caloric restriction increases brain mitochondrial calcium retention capacity and protects against excitotoxicity. Aging Cell. 13 sept. 2016.
MORI, M. A. et al. Role of microRNA processing in adipose tissue in stress defense and longevity. Cell Metabolism. 5 sept. 2012.


