El año 2019 recién comenzaba cuando científicos de la agencia reguladora de alimentos y medicamentos de Estados Unidos, la FDA, se toparon con una sorpresa al testear una nueva metodología de bioinformática que comprende la aplicación de técnicas informáticas a investigaciones en el campo de la biología. Casi por casualidad, descubrieron que dos toros clonados algunos años antes por la empresa Recombinetics, cuyo linaje celular había sido sometido a edición génica para suprimir los cuernos de los animales, en realidad eran transgénicos. Hasta entonces ese dato era desconocido, pero los animales portaban en su genoma el material genético de otra especie, específicamente, el de un plásmido que se emplea en la edición génica. Los plásmidos son pequeñas moléculas de ADN de origen bacteriano que se utilizan como vectores de inserción de genes en diversos tipos de células.
Las autoridades estadounidenses consideraron tan relevante ese hallazgo que, inmediatamente, publicaron el resultado en un servidor de preprints, que da a conocer el artículo antes de su revisión por pares. El texto fue publicado online en julio de 2019 y, hasta el cierre de esta edición, se aguardaba su publicación en la revista Nature Biotechnology. “Nuestros hallazgos revelaron dónde habría que buscar efectos no intencionales de ediciones génicas que los científicos, hasta ahora, no habían advertido”, dijo Heather Lombardi, directora de la División de Bioingeniería Animal y Terapias Celulares del Centro de Medicina Veterinaria de la FDA en declaraciones a Pesquisa FAPESP (lea la entrevista en la página 25). “Enterarse de que un plásmido entero puede entrar –y a veces de hecho eso ocurre– en el genoma de un animal, ayudará a perfeccionar la calidad de la investigación científica y de los productos desarrollados”.
Este descubrimiento se concretó gracias a un imponderable. En 2018, la FDA estaba abocada al proceso de desarrollar un método de análisis de datos obtenidos por secuenciación de nueva generación (NGS) –una técnica que identifica un orden de bases nitrogenadas de miles de millones de moléculas de ADN en forma simultánea– para emplearlo en las resoluciones regulatorias. El equipo del Centro para Medicina Veterinaria de la FDA, a cargo del estudio, necesitaba validar la metodología con datos ya conocidos y optó por efectuar el test con las informaciones de un trabajo publicado en 2016 en la Nature Biotechnology que versaba sobre la secuenciación genética de dos bovinos originados a partir de células que habían sido editadas en 2013.
El artículo en cuestión, firmado por el investigador estadounidense Daniel F. Carlson y otros colegas, describía la experiencia exitosa de edición génica que había sido desarrollada en los animales por Recombinetics, una empresa con sede en la ciudad de St. Paul, estado de Minnesota (EE.UU.). Ese trabajo dio como resultado dos toros mestizos de razas lecheras, usualmente con cuernos, que alcanzaron una edad madura sin que los mismos les crezcan, o sea, eran mochos. Las variantes genéticas asociadas a la ausencia de cuernos son comunes en el ganado de corte, pero raras en el rebaño lechero. Hay un fuerte interés comercial para la producción de ganado lechero mocho, pues los cuernos dificultan el manejo de los animales y, a menudo, los productores optan por realizar el descornado, un proceso costoso, delicado y doloroso.
“Como nuestro proceso fue concebido para detectar cambios en el ADN en muestras con edición genómica, queríamos un conjunto de datos para validarlo del cual se dispusiera tanto de las muestras editadas como de las muestras de control”, relató Lombardi. “Se eligió el conjunto de datos de Carlson y su equipo porque el mismo disponía de resultados conocidos. En aquella época, ese era el único conjunto de informaciones disponible a nivel público sobre animales con edición genómica acerca del cual teníamos conocimiento. Además, los datos eran numerosos y de buena calidad”.
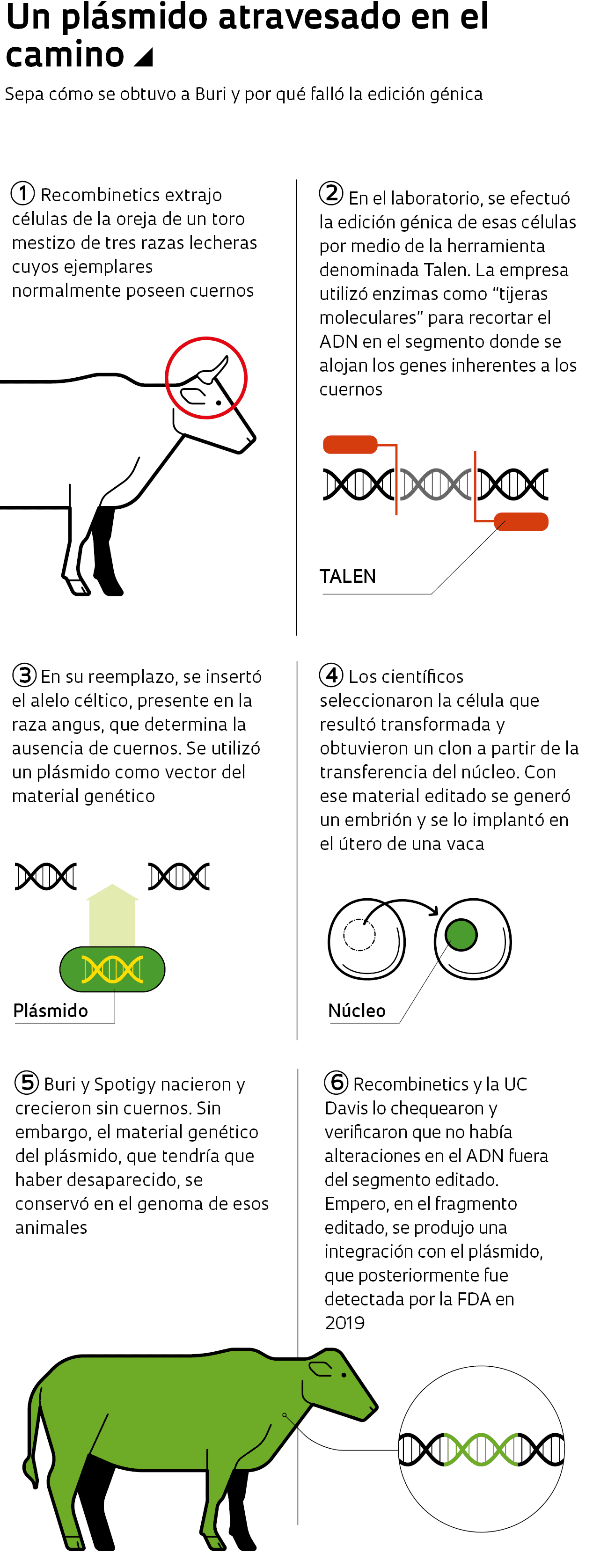
El caso es que entre mayo de 2015, cuando nacieron los dos terneros que fueron nombrados Spotigy y Buri, y 2019, ocurrieron muchas cosas. Y esa historia incluso tuvo repercusiones en Brasil. Ambos animales, clones de un mismo toro de la Universidad de Minnesota, crecieron sanos, al igual que los becerros que se usaron como control, cuyo genoma no fue editado. En noviembre de 2015, cuando tenían alrededor de seis meses de edad, se los trasladó al campus de la Universidad de California (UC) en Davis, para estudiarlos. A Spotigy lo sacrificaron para estudiar su organismo, y en cuanto a Buri, su semen fue congelado y posteriormente, vía inseminación artificial, fue padre de seis terneros, cinco machos y una hembra. La prole nació en septiembre de 2017 en la UC Davis, de seis vacas diferentes de raza hereford, que naturalmente tienen cuernos. Cuatro de los seis becerros heredaron la secuencia con ADN bacteriano en el genoma.
En octubre de 2019, la revista Nature Biotechnology publicó un artículo en el cual se analizaba el genotipo y el fenotipo de esos animales que heredaron la característica mocha de Buri. El estudio fue coordinado por Alison L. Van Eenennaam, una científica australiana de la UC Davis, radicada en EE. UU., que contó con el apoyo del Departamento de Agricultura de Estados Unidos y de Recombinetics.
Durante el primer semestre de 2018, previo a la divulgación del hallazgo de la FDA, la empresa paulista AgroPartners Consulting, de la localidad de Araçatuba, que presta consultoría en el área de genómica en plantas y animales, le propuso a Recombinetics importar el semen del toro Buri a Brasil. “La idea era inseminar algunas vacas, generar un caso novedoso y realizar una demostración de esa tecnología en el país”, relató el veterinario José Fernando Garcia, socio de AgroPartners y docente en la Facultad de Medicina Veterinaria de la Universidade Estadual Paulista (Unesp), campus de Araçatuba.
En 2018, AgroPartners le envió una carta consultiva a la Comisión Técnica Nacional de Bioseguridad (CTNBio) solicitando permiso para importar el semen de Buri para realizar investigaciones y abrir la posibilidad para la comercialización futura de ese tipo de tecnología a otras empresas. En enero de ese año, la CTNBio había aprobado la resolución normativa número 16, estableciendo los requisitos para las Técnicas Innovadoras de Mejora de Precisión (TIMPs) –en las cuales se encuadraría la edición génica de Buri– y diferenciándolas de la ingeniería genética por transgénesis.
La CTNBio determinó que el semen de Buri no era un organismo genéticamente modificado (OGM), en concordancia con lo que se describe en el artículo 3º de la Ley 11.105 de marzo de 2005, la Ley de Bioseguridad. La comisión tuvo en cuenta los datos disponibles hasta ese momento, subrayando que la modificación introducida –la inhibición del gen responsable del desarrollo de los cuernos– se produce naturalmente en otras razas bovinas.

Alison Van Eenennaam/ University of California-Davis
Princess, la hija de Buri (a la der.), junto a otro ejemplar de control, en las instalaciones de la Universidad de California, en DavisAlison Van Eenennaam/ University of California-DavisProyecto abortado
La empresa paulista se aprontaba a importar el semen cuando se anunció el descubrimiento efectuado por la agencia regulatoria estadounidense. “Ellos se enteraron del hallazgo de la FDA e informaron a la CTNBio, solicitando la cancelación del proceso e informando que no importaría el semen del toro”, dijo la veterinaria Maria Lúcia Zaidan Dagli, docente de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad de São Paulo (USP), e informante del proceso en la CTNBio, de la cual es vicepresidenta.
Según refiere Garcia, el semen de Buri no llegó a enviarse a Brasil. En Estados Unidos, cinco de los seis descendientes del toro genéticamente modificado fueron sacrificados. Tan solo sobrevive la hembra, Princess, que heredó la secuencia con ADN bacteriano en el genoma, para continuar como objeto de investigación. “Ella convive con un toro de raza hereford y esperamos que esté preñada”, relató Van Eenennaam, de la UC Davis. “Evaluaremos su leche para realizar un análisis de su composición, tal como sugirió la FDA. Tanto Princess como su ternero serán tratados como nuevas drogas animales [new animal drugs], de acuerdo con la normativa de la agencia y no podrán utilizarse en la cadena alimentaria. Ellos serán sacrificados e incinerados.”
El estudio y comercialización de organismos transgénicos generalmente se encuentran regulados por normas estrictas, que difieren según el país. Para la Organización Mundial de la Salud (OMS), si bien las discusiones abarcan varios aspectos de la transgénesis, hay tres puntos que son motivos de debate: los posibles efectos alergénicos de esos organismos, la posibilidad de transferencia de material genético, especialmente de genes de resistencia a los antibióticos, y los riesgos de cruzamiento sin control de esos organismos con otros no transgénicos.

US Food and Drug Administration
El laboratorio de la FDA: el organismo detectó que el genoma de Buri poseía material genético del plásmidoUS Food and Drug AdministrationEdición con TALEN
La empresa Recombinetics utilizó en la edición génica de los linajes celulares de los toros una técnica denominada Talen, las siglas en inglés que significa nucleasas efectoras del tipo activador de transcripción. Otra técnica de edición bastante adoptada actualmente, más sencilla, rápida y económica, es la CRISPR-Cas9 (lea el reportaje en la página 12). Ambas permiten realizar una alteración específica en un gen o en un segmento determinado del genoma, inhibiendo ciertas características o introduciendo modificaciones.
“Ambas funcionan como una tijera molecular. Ellas recortan el ADN”, explica la bióloga Ângela Saito, investigadora del Centro Nacional de Investigación en Energía y Materiales (CNPEM). “Pero la TALEN utiliza proteínas modificadas para reconocer una secuencia específica en el ADN de interés, y en el caso de la CRISPR, lo que reconoce el segmento de interés es una molécula de ARN [ácido ribonucleico], cuya construcción es más rápida y sencilla que el proceso de ‘diseñar’ una proteína”.
Tanto la técnica TALEN como la CRISPR-Cas9 pueden utilizar o no plásmidos como modelos, que transportan las instrucciones genéticas. A pesar de que el plásmido es una herramienta común en los laboratorios de biotecnología, muchos investigadores prefieren sintetizar el modelo de forma tal que ese organismo pueda degradarse y, siendo así, no queden vestigios del mismo ni se corra el riesgo de que sea incorporado al ADN.
“En 2013, tuvimos que usar un vector con plásmido porque aún no había opciones disponibles para realizar copias exactas del alelo céltico –así denominado por ser la porción del ADN responsable del carácter astado/ mocho, compartido por razas británicas y europeas– [una inserción de 212 pares de bases y una deleción de 10 pares de bases]”, le dijo Daniel Carlson, director científico de Recombinetics, a Pesquisa FAPESP, en referencia a la alteración del genoma bovino que garantizó la ausencia de cuernos en los toros. “En 2014, cuando hicimos el screening [tamización] de las células editadas, el laboratorio no buscó directamente el plásmido. La integración de un modelo con plásmido por entonces era considerada –y aún sigue siéndolo– un evento raro, según se consigna en la literatura científica”.
Tanto Recombinetics como la UC Davis no llegaron a buscar específicamente la integración del plásmido antes del descubrimiento efectuado por la agencia FDA. En el caso de Buri, la alteración inesperada del genoma del toro se produjo en uno de los alelos del gen responsable por la presencia o ausencia de cuernos. En el otro alelo, la alteración ocurrió de la manera en que los científicos preveían y deseaban. Cada gen que determina un fenotipo (una característica) posee dos alelos, que pueden ser idénticos (homocigotos) o no (heterocigotos). Si no fueran idénticos, el alelo dominante determinará la característica resultante.
Con el alelo céltico dominante, Buri y su hermano no presentaban cuernos. Y lo mismo ocurrió con la prole de Buri, fruto de la cruza con vacas de la raza hereford, que en general tienen cuernos, que nacieron mochos. Sin embargo, el otro alelo del mismo gen responsable por la presencia o ausencia de cuernos sufrió la alteración inesperada conservando en su secuencia el ADN bacteriano integrado.
En general, los plásmidos que se usan como vectores en los laboratorios de biología molecular poseen genes que les confieren resistencia a los antibióticos. Y ese fue el caso del material genético integrado en el toro Buri, que incluyó los genes de resistencia a los antibióticos. Los expertos de Recombinetics, UC Davis, CTNBio y AgroPartners no creen que eso sea un problema. “Los fragmentos del plásmido poseen genes bacterianos que no funcionan en el organismo de un mamífero. Esos genes sólo son activos en la bacteria, porque ella reconoce a ese gen como suyo y desencadena la resistencia al antibiótico”, sostiene Garcia, de AgroPartners. “En el vacuno, ese gen se mantiene como un fragmento inerte. El código es diferente, no cuenta con la maquinaria de la región promotora necesaria para la expresión del gen”.
El veterinario Marcelo Demarchi Goissis, investigador de la Facultad de Medicina Veterinaria y Zootecnia de la USP, coincide con Garcia, pero advierte: “En teoría, ese gen se encuentra ahí inactivo, pero esto es biología, y ya se sabe que en la biología ocurren cosas imprevistas”, dice. “En principio no habría problemas, pero lo ideal sería que no se hubiera producido la integración del ADN del plásmido con la del genoma bovino, porque resulta difícil prever lo que sucedería con toda una población de animales con esa característica”.
Un artículo sobre el tema en la revista estadounidense MIT Technology Review, del Massachusetts Institute of Technology (MIT), refiere que no está claro si la presencia del ADN bacteriano significa necesariamente un riesgo mayor. Si bien es improbable que el plásmido afecte al propio bovino o a la persona que consuma su carne, lo que preocupa es que el gen de resistencia al antibiótico se transmita a alguna de las miles de millones de bacterias presentes en el organismo del toro o de la vaca. La presencia de ese gen en una vaca generaría oportunidades imprevisibles para su difusión, le confió a la revista el microbiólogo John Heritage, de la Universidad de Leeds, en el Reino Unido.
Según se afirma desde Recombinetics, la empresa nunca tuvo la intención de obtener la aprobación de la FDA para la venta de esos animales en Estados Unidos o en otros países. “La base genética del ejemplar denominado Buri no tiene valor comercial, por ende, procurar su aprobación regulatoria no tendría ningún sentido a nivel comercial”, comenta Carlson. Según Van Eenennaam, de la UC Davis, Buri fue un prototipo para testear si la edición podría dar como resultado una característica dominante de ausencia de cuernos en el toro. El próximo paso lógico sería introducir esa edición en un toro selecto de una raza con cuernos utilizando métodos que no involucren ADN con un donante plásmido.
En opinión de José Fernando Garcia, el caso fue un “atasco científico”. “Para nosotros eso no significó un gran problema. Ya están llegando otros animales cuyo genoma también fue editado, tanto en Estados Unidos como en Brasil, que están próximos a nacer. Esos ejemplares y toda su documentación biológica serán sometidos al análisis de la CTNBio en forma natural y transparente, tal como se vino haciendo hasta ahora”.
Artículos científicos
CARLSON, D. F. et al. Production of hornless dairy cattle from genome-edited cell linhas. Nature Biotechnology. n. 5, p. 479-81. 2016.
YOUNG, A. E. et al. Genomic and phenotypic analyses of six offspring of a genome-edited hornless bull. Nature Biotecnolgy. oct. 2019.
NORRIS, A. L. et al. Template plasmid integration in germline genome-edited cattle. bioRxiv. Online. 28 jul. 2019.


