Las interrupciones en los llamados ensayos clínicos de vacunas y medicamentos realizados en seres humanos se consideran como percances inherentes al proceso de desarrollo de nuevos productos. Cuando se detecta algún efecto colateral grave que puede estar asociado al uso del agente inmunizante o de la droga, o el fallecimiento inesperado de uno de los participantes en los experimentos, los impulsores de los test deben evaluar si es seguro proseguir con los mismos. En ciertas ocasiones, las autoridades sanitarias obligan a los desarrolladores a suspender los ensayos hasta que se demuestren las causas del incidente y la seguridad del producto. Si las explicaciones demuestran que no existe una relación clara con el fármaco probado, pueden reanudarse los trabajos. De lo contrario, las pruebas pueden abandonarse.
El público rara vez se entera de estos contratiempos. Pero entre septiembre y octubre, los ensayos clínicos de la fase III, la última etapa previa a la aprobación final de dos de las vacunas contra el covid-19 –la de la empresa británica AstraZeneca en colaboración con la Universidad de Oxford y la de la farmacéutica Janssen, del grupo estadounidense Johnson & Johnson– sufrieron interrupciones que se convirtieron en noticias. En ambos casos, las pruebas se reanudaron, pero la difusión de la suspensión temporal de las investigaciones generó preocupación. Las dos vacunas utilizan diferentes adenovirus (virus que causan problemas respiratorios en animales y en humanos) para transportar material del Sars-CoV-2 que es capaz, en teoría, de estimular una respuesta inmunológica en sus receptores.
– El ajedrez global de la pandemia
– La incógnita de las reinfecciones
– Transmisión restringida
En la fase III de los test, mientras que una parte de los voluntarios recibe la droga que se está probando, a otro grupo se le suministra un placebo, un compuesto inocuo. Para garantizar la idoneidad del proceso, los impulsores de los ensayos no conocen de qué grupo forman parte los participantes en los estudios. Las reacciones adversas que se consideran habituales, como los dolores de cabeza leves y en la zona de aplicación de la vacuna, no son suficientes como para que se paralice un protocolo. Cuando los síntomas son más graves, tales como la aparición de inflamaciones en el sistema nervioso o incluso el riesgo de muerte, la situación cambia, y se recurre a una comisión independiente para que analice el caso. “En los ensayos clínicos de gran alcance siempre surgen complicaciones. Esto es normal y el comité de expertos evalúa la situación”, pondera el inmunólogo Jorge Kalil, de la Facultad de Medicina de la Universidad de São Paulo (FM-USP) y director del Laboratorio de Inmunología del Instituto del Corazón (InCor). “Puede que los problemas no estén relacionados con la vacuna. Cuando esto se comprueba, el estudio prosigue. La esperanza en las vacunas contra el covid-19 sigue siendo elevada”.
El primer contratiempo se hizo público hace unos dos meses. El 8 de septiembre, la compañía AstraZeneca, que está probando su candidata a vacuna en 50 mil personas del Reino Unido, Brasil, la India, Sudáfrica y Estados Unidos, divulgó un comunicado confirmando una noticia que había sido publicada dos días antes por la prensa: los ensayos se habían suspendido porque un participante británico del estudio presentó reacciones adversas. Este enfermó sin que hubiera una explicación y desarrolló mielitis transversa, una inflamación que afecta a la médula espinal. El agente inmunizante había sorteado sin mayores sobresaltos las fases I y II de los ensayos clínicos. “La vacuna de Oxford le ha sido aplicada a un gran número de voluntarios. Por eso es muy posible que ocurra una situación de este tipo y no necesariamente debe atribuírsela al producto que se está probando”, dice el virólogo Celso Granato, de la Universidad Federal de São Paulo (Unifesp) y director clínico del Grupo Fleury.
Las explicaciones esgrimidas por AstraZeneca, disociando este problema de salud de la aplicación de la vacuna, fueron consideradas satisfactorias, por lo que los países reanudaron las pruebas en curso, algunos en forma más rápida y otros más lentamente. En Brasil, una semana después de haberse anoticiado el incidente, los estudios con el inmunizante se retomaron. En Estados Unidos, el permiso se otorgó recién el 23 de octubre. El periódico O Globo divulgó otro episodio el 21 de octubre, sobre la muerte de un voluntario que participó en los test de la vacuna británica en Brasil. Pero, según el diario, ese individuo formaba parte del grupo de control, que había recibido el placebo y no el inmunizante, por ende, el caso no suscitó la suspensión de las pruebas.
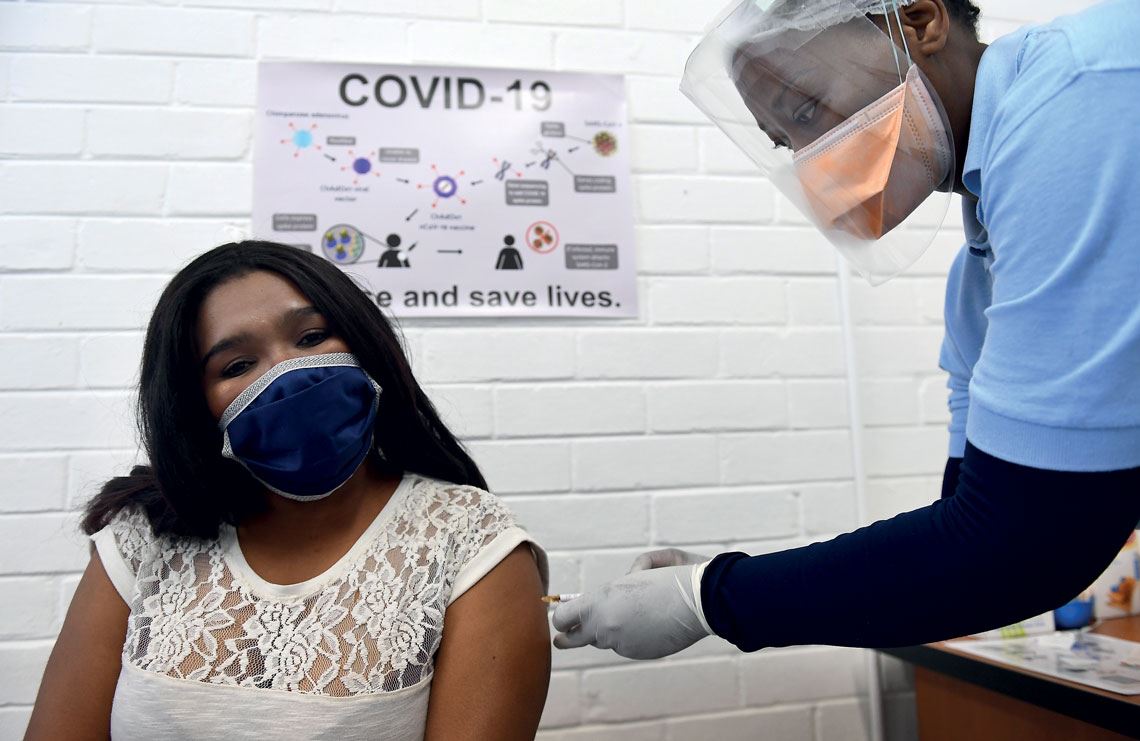
Felix Dlangamandla/Beeld/Gallo Images vía Getty Images
Aplicación de la vacuna de AstraZeneca durante los ensayos clínicos en curso en SudáfricaFelix Dlangamandla/Beeld/Gallo Images vía Getty ImagesLa segunda candidata a vacuna en fase III cuyos ensayos clínicos se suspendieron temporalmente fue la de la subsidiaria del grupo Johnson & Johnson. La interrupción se produjo oficialmente en Estados Unidos el 12 de octubre. El motivo fue similar al que afectó a las pruebas de la vacuna de AstraZeneca: un voluntario habría sufrido un derrame, cuya causa debió investigarse. No se divulgó si el individuo que sufrió ese incidente pertenecía al grupo de control o había recibido la vacuna. El 23 de octubre, el periódico estadounidense Washington Post anunció que la empresa había recibido luz verde de la FDA, la autoridad sanitaria de aquel país, para la reanudación de los test.
Más allá de las dos vacunas, las pruebas realizadas por los Institutos Nacionales de Salud (NIH) con un tratamiento experimental contra el covid-19 también se suspendieron a causa de posibles efectos adversos. Eso fue lo que ocurrió con el empleo del anticuerpo monoclonal desarrollado por el laboratorio estadounidense Eli Lilly, un medicamento elaborado con leucocitos de uno de los primeros pacientes recuperados de la infección por el Sars-CoV-2 en Estados Unidos. La interrupción de esa terapia, similar a una de las que se le habían utilizado con el presidente Donald Trump durante su internación a causa del nuevo coronavirus, se notició el 13 de octubre sin demasiadas explicaciones.
Según la empresa, hubo una discrepancia importante en la condición clínica de los voluntarios que recibieron el placebo en comparación con la de los medicados con el anticuerpo monoclonal, a los cuales también se les administró otra droga experimental, el remdesivir. Esa situación motivó la suspensión de los estudios para revisar los protocolos. Por más que la empresa reclama una aprobación de emergencia para su tratamiento, los ensayos patrocinados por los NIH aún no han sido reanudados.
A causa de la gravedad de la pandemia, los test con vacunas y medicamentos se están desarrollando a una velocidad sin precedentes y cuentan con una gran cobertura de los medios de comunicación. “La expectación y la ansiedad generan gran confusión entre el público lego”, dice Paulo Lotufo, director del Centro de Investigaciones Clínicas y Epidemiológicas de la USP. “Normalmente, son pocas las personas que se interesan por los ensayos clínicos pues estos se refieren a enfermedades específicas”, dice Lotufo.

Olivier Matthys/Getty Images
Técnicos trabajando en el laboratorio de Janssen, en Bélgica, que produce una de las posibles vacunas contra el covid-19, que sufrió una breve interrupción en sus pruebasOlivier Matthys/Getty ImagesPero puesto que las vacunas están destinadas a las personas sanas, hay que redoblar las precauciones. Según Lotufo, un ejemplo hipotético realza la importancia de que las pruebas con los inmunizantes se realicen con todo rigor. “Imagínense un medicamento para el cáncer de pulmón con resultados muy buenos, que incremente en dos años la sobrevida de los pacientes, pero también eleve la incidencia de diabetes en el 50% de los casos. En ese contexto, el nuevo problema de salud no reviste demasiada importancia. Algunos pacientes con cáncer ya son diabéticos y esta es una enfermedad que ya sabemos cómo controlar”, reflexiona el epidemiólogo. “Pero esa situación cambia si tenemos por delante a una vacuna que, pese a ser muy eficaz, aumenta el riesgo de producir diabetes en personas sanas, algo muy malo”.
El hecho de que el fracaso sea mucho más habitual que el éxito en los ensayos con vacunas se basa en los números. Un estudio publicado en el mes de mayo en el repositorio del National Bureau of Economic Research (NBER), a partir del trabajo de científicos del Massachusetts Institute of Technology (MIT), revela que en Estados Unidos, el índice de aprobación de nuevas vacunas entre enero de 2000 y enero de 2020 fue de un 39,6%. Los investigadores analizaron 1.838 ensayos clínicos patrocinados por la industria farmacéutica desde la fase I y determinaron que mayormente se quedaron en el camino.
Otro informe publicado en 2017 por la FDA muestra que el arribo a la recta final del proceso de desarrollo de un fármaco no significa necesariamente su aprobación. En el estudio se evaluaron 22 casos que han fracasado en los últimos años. De ese total, cinco eran vacunas y todas fueron reprobadas de manera definitiva durante la fase III, principalmente por falta de eficacia.
Los proyectos farmacéuticos que naufragaron pugnaban por la obtención de vacunas específicas: contra el herpes genital, para conservar la producción de insulina en pacientes con diabetes tipo 1, para el tratamiento de pacientes recién operados de un tipo de cáncer de pulmón, contra el tabaquismo, y para prevenir la infección por Staphylococcus aureus, una bacteria que puede causar neumonía o endocarditis.
En el caso del nuevo coronavirus, como las vacunas tienen como público objetivo a gran parte de la población global, la cantidad de personas requeridas para la fase III debe ser aún mayor. Por eso el riesgo de que surjan problemas también se eleva. Pero, como compensación, el alto número de agentes inmunizantes en fase de pruebas avanzadas incrementa las posibilidades de que algunas de ellas resulten exitosas. De las 44 vacunas en desarrollo contra el coronavirus que se están probando en humanos, 10 se encuentran en el final de la fase III. “Es necesario multiplicar los esfuerzos para lograr una vacuna segura y eficaz, pero en el menor tiempo que permitan los protocolos de seguridad”, dice Granato.
Republicar